中国科学院微生物研究所,中国微生物学会
文章信息
- 张建云, 谷立坤, 王亚西, 李潇扬, 宁志琪, 孙淼焜, 张欣, 白志辉. 2024
- ZHANG Jianyun, GU Likun, WANG Yaxi, LI Xiaoyang, NING Zhiqi, SUN Miaokun, ZHANG Xin, BAI Zhihui.
- 植物叶际好氧反硝化细菌的筛选及其脱氮性能研究
- Aerobic denitrifying bacteria in the phyllosphere: screening and characterizing of nitrogen removal performance
- 微生物学报, 64(5): 1521-1537
- Acta Microbiologica Sinica, 64(5): 1521-1537
-
文章历史
- 收稿日期:2023-11-24
- 网络出版日期:2024-02-26
2. 中国科学院生态环境研究中心, 北京 100085
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
空气污染问题已经成为人们关注的热点,氮氧化物的排放作为空气污染的原因之一,已经成为环境领域不可忽略的问题[1]。植物对空气中的氮氧化物的净化发挥着重要的作用[2-3]。全球植物地上部分总表面积大约为109 km2 (大多数为叶表面),在叶面上分布着大量的微生物,其中细菌的平均含量为106−107个细菌细胞/cm2叶片表面积[4]。除了叶面上,在植物的茎、花、果等组织表面也包含大量的微生物,定殖在这些部位的微生物通称为叶际微生物(phylloplane microorganism)[5-6]。研究表明,叶际微生物具有重要的生态功能[7-8],与植物关系密切,参与植物固氮[9-10],促进植物生长[11],参与植物健康调节[12]。同时,一些针对土壤污染物如抗生素、农药等[13]和空气污染物如臭氧[14]等环境胁迫导致的叶际微生物群落结构和多样性的变化的研究,有助于理解叶际微生物其他的潜在功能。叶际微生物数量巨大且功能多样,这些微生物是否参与大气氮氧化物的净化,以及如何协同植物进行大气氮氧化物净化的问题,尚缺乏系统的研究。
反硝化作用是生物地球化学循环中重要的生态过程,是去除硝态氮的途径之一[15]。在传统理论中,反硝化被认为是一种严格的厌氧过程。然而,自从20世纪80年代Robertson等[16]首次分离出好氧反硝化细菌以来,研究人员逐渐从不同的环境中分离出多种可以进行好氧反硝化的细菌[17-20],好氧反硝化细菌的发现为水体的生物脱氮技术提供了新的研究方向,但也会使土壤损失硝酸盐,降低土壤的营养。目前已分离纯化出的好氧反硝化细菌多来自湿地、水库、土壤、湖泊沉积物、污废水、活性污泥和池塘当中[17],对于植物叶际可培养的好氧反硝化细菌的研究却鲜有报道。
好氧反硝化细菌在叶际中是否存在,在植物削减氮氧化物的过程中是否发挥作用,如何发挥作用,这是本文及后续研究需要揭示的问题。王月等[21]研究表明,在环境湿度达到一定程度后,植物叶面会附着一层水膜,空气中的气态NO2可能会溶于水膜形成硝酸盐。周敏等[22]测得大气颗粒物中水溶性NO3−的含量在0.61−15.34 μg/m3之间,而植物表面的微观结构能够有效吸附自然沉降到叶面的微小颗粒物[22],这是叶面硝酸盐的另一个来源。在2023年的3月到5月,我们课题组对景观植物石楠和女贞的叶片硝酸盐含量和亚硝酸盐含量进行了持续监测,测得的硝酸盐含量与周敏等[22]的结果相近。基于以上结果,我们提出以下假设:大气中的氮氧化物溶解于叶际表面的水膜形成的硝酸盐和来源于微颗粒物中的可溶性硝酸盐成为叶面硝酸盐利用菌或反硝化细菌的氮源,其中的一部分被细菌同化用于合成细菌的菌体,另一部分通过反硝化途径将叶际硝酸盐还原为无害的氮气释放到空气中,从而达到协同植物削减大气氮氧化物的目的。
为了验证该假设,采用富集培养结合格里斯试剂检测、溴百里酚蓝(bromothymol blue, BTB)平板筛选的方法从6种校园景观植物石楠、女贞、木樨、樟树、卫矛冬青、荷花玉兰中分离纯化出13株好氧反硝化细菌,对其进行16S rRNA基因序列分析和种属鉴定,对反硝化途径的关键基因周质硝酸盐还原酶基因napA进行检测,并对其中的一株高效好氧反硝化细菌SF进行了系统的脱氮性能的研究。
景观植物叶际好氧反硝化细菌资源的挖掘,为探索叶际微生物协同削减大气氮氧化物的机制奠定了工作基础,为进一步应用微生物协同植物削减空气氮氧化物污染提供了候选菌株。
1 材料与方法 1.1 样点本研究选取6种典型景观植物作为研究对象,从其叶表面筛选好氧反硝化细菌,地点在河南工程学院西校区院内,分别为2号教学楼道路两侧的卫矛树、2号教学楼后面的樟树、学校南门附近的木樨树、大西门道路两侧的女贞树、3号实验楼后面的荷花玉兰树、6号教学楼附近的石楠树(文中用WF表示从卫矛冬青中筛选出的细菌,SF代表从石楠中筛选出的细菌,MF代表从木樨中筛选出的细菌,ZF代表从樟树中筛选出的细菌,NF代表女贞中筛选出的细菌,HF代表荷花玉兰中筛选出的细菌)。
1.2 培养基富集培养基[23] (g/L):牛肉膏3.00,蛋白胨5.00,KNO3 1.00,pH 7.0−7.6。
分离培养基[23] (BTB培养基,g/L):KNO3 1.00,柠檬酸三钠1.00,KH2PO4 1.00,FeSO4·7H2O 0.05,CaCl2 0.20,MgSO4·7H2O 1.00,1%溴百里香酚蓝1.00 mL,琼脂20.00,pH 6.8。
反硝化性能测定培养基[24] (g/L):柠檬酸三钠1.31,乙酸钠1.10,KNO3 0.36,MgSO4·7H2O 0.02,KH2PO4 1.00,K2HPO4 5.00,NaCl 0.50,微量元素溶液1.00 mL。
微量元素溶液(g/L):EDTA-Na2 30.00,ZnSO4 2.20,CaCl2 5.50,MnCl2·4H2O 5.06,FeSO4·7H2O 5.00,CuSO4·7H2O 1.57,CoCl2·6H2O 1.61,pH调至7.0−7.5。
1.3 好氧反硝化细菌的富集、分离和筛选 1.3.1 好氧反硝化细菌的富集培养分别摘取学校2号教学楼道路东侧的石楠、卫矛和樟树的树叶以及南大门附近的木樨、女贞和荷花玉兰的树叶,放在密封袋中,写上标签。每种样品均称取10 g,分别加到90 mL无菌水中,200 r/min振荡3 h,静置1 h后,取10 mL上清液到90 mL反硝化富集培养基中,置于30 ℃、150 r/min的恒温摇床中进行培养。设置两组平行样品。
1.3.2 格里斯试剂的定性检测每天使用格里斯试剂[24]定性检测培养基中亚硝酸盐含量。取2 mL样品,滴加一滴格里斯试剂观察颜色变化。出现粉红色或棕色证明有亚硝酸盐产生。当检测到亚硝酸盐产生时,准备富集一代的样品直接进行BTB固体培养基涂布[25]。准备富集三代的样品吸取10 mL富集液到250 mL锥形瓶中,再向其中加入90 mL新配制的富集培养基,继续培养。重复以上操作,富集3次后进行BTB固体培养基涂布操作。
1.3.3 BTB固体显色培养基的快速筛选取6种样品富集一代和富集三代的富集液1 mL,用无菌水对每个样品进行系列梯度稀释,稀释梯度分别为10−1、10−2、10−3、10−4、10−5倍。取不同稀释倍数的稀释液100 μL涂布于BTB反硝化固体培养基上,30 ℃恒温培养2−3 d。在选择培养基变蓝色的平板上,挑取形态差别比较明显的菌落进行平板划线获取单菌落。共分离得到16株菌株,按照来源和富集代数分别命名为MF11、MF12、WF11、ZF11、ZF12、ZF31、HF12、HF、NF、NF31、NF32、SF、TF31、TF12、TF13和SF3。其中3株来源于景观林区土壤,作为筛选过程中的对照样品,其余13株来源于景观植物叶际。TF代表从林区土壤中筛选出的菌株。
1.3.4 好氧反硝化细菌反硝化效率的测定[25]将分离纯化好的好氧反硝化细菌转接于以KNO3为唯一氮源的反硝化培养基中,在30 ℃、150 r/min条件下恒温培养,每隔4 h取少量菌液(取样前摇匀)测定600 nm下的吸光度,确定其生长曲线。以对数生长期的菌液为种子培养基,按1%的接种量转接于反硝化性能测定培养基中,测定菌液0、12、24、36、48、72 h的硝态氮含量、亚硝态氮含量、OD600数值和菌液总氮含量。定量判断菌株好氧反硝化能力的强弱。
1.4 菌株鉴定从形态学、生理生化实验、分子生物学、功能学等几个方面对菌株进行鉴定。通过平板划线和革兰氏染色法观察菌落形态及菌体形态。细菌生理生化鉴定主要参考《常见细菌系统鉴定手册》[26]。分子生物学鉴定采用16S rRNA基因序列分析法。细菌总DNA的提取:采用细菌基因组DNA提取试剂盒(TIANGEN公司)进行提取,方法参考试剂盒说明书。
1.4.1 16S rRNA基因序列的扩增[27]引物采用27F (5′-AGAGTTTGATCCTGGC TCAG-3′)和1492R (5′-TACGGCTACCTTGTTA CGACTT-3′)。PCR反应条件:94 ℃预变性5 min;95 ℃变性l min,55 ℃退火l min,72 ℃延伸1 min,共30个循环;72 ℃总延伸10 min。
1.4.2 反硝化途径关键基因硝酸盐还原酶[28-29] napA的扩增引物采用上游引物(5′-TCTGGACCATGG GCTTCAACCA-3′)和下游引物(5′-ACGACGAC CGGCCAGCGCAG-3′)。PCR反应条件:94 ℃预变性5 min;95 ℃变性l min,65 ℃退火l min,72 ℃延伸1 min,30个循环;72 ℃总延伸10 min。
1.4.3 16S rRNA基因序列测序及分析扩增得到的16S rRNA基因序列由河南尚亚生物技术有限公司进行测序。测序结果在NCBI数据库中进行序列比对,使用MEGA 7.0软件的邻接(neighbor-joining, NJ)法构建系统发育树。napA基因序列由河南尚亚生物技术有限公司测序,基于napA基因序列的系统发育树使用MEGA 7.0软件的邻接法(neighbor-joining, NJ)构建。
菌株反硝化能力的测定通过监测培养基中硝酸盐和亚硝酸盐含量的变化来确定。
1.5 好氧反硝化细菌脱氮性能研究从前期筛选的菌株中选取了一株表现出良好脱氮能力的好氧反硝化细菌,进行脱氮性能研究。先采用单因素实验探究不同环境因子[碳源、温度、溶解氧、碳氮比(C/N ratio, C/N)和初始pH\对好氧反硝化性能的影响,在此基础上用响应面法进行脱氮条件优化,以确定最佳脱氮条件。
1.5.1 单因素对菌株脱氮的影响按体积分数2%接种量将处于对数生长期的菌液(OD600为1.0)接到反硝化培养基(总体积为100 mL)中,通过调节温度[30] (25、30、35、40 ℃)、pH值(5.0、6.0、7.0、8.0、9.0)、C/N[31] (3、6、8、10、15)、碳源[32-33] (甲醇、丁二酸钠、柠檬酸钠、酒石酸钾钠、蔗糖和葡萄糖)和转速[34-35] (0、100、120、150和180 r/min)摇床培养,每隔12 h测定培养液中菌体生长量和总氮(total nitrogen, TN)含量。考察不同的因子对脱氮效果的影响。除温度实验外,其余均在30 ℃下培养,实验设3个重复。
1.5.2 响应面优化脱氮效率条件采用响应面分析方法中的Box-Behnken设计(Box-Behnken design, BBD)试验设计原理来优化脱氮条件[36]。这种设计方法基于单因素试验设计,其中包括中心值(表示为“0”)、低水平(表示为“−1”)和高水平(表示为“+1”)。选择对脱氮过程影响最大的主要因素作为自变量,并以TN的去除效率作为响应值(Y),进行实验设计。综合考虑多个因素对脱氮效率的影响,并找到最佳的脱氮条件。最后用设计得到的最佳脱氮条件来验证菌株的脱氮效果。将根据响应面模型的预测脱氮结果与菌株在验证实验中的TN去除率进行比较,以验证响应面模型的可靠性。
1.6 检测方法硝酸盐氮的测定采用紫外分光光度法HJ/T 346—2007[37],亚硝酸盐氮的测定采用盐酸萘乙二胺分光光法GB 7493—87[38],总氮的测定采用过硫酸钾氧化-紫外分光光度法HJ 636—2012[39]。
2 结果与分析 2.1 好氧反硝化细菌筛选结果及多样性分析经富集培养基培养后的培养液经梯度稀释,BTB培养基分离、纯化,反硝化培养基定性复筛,从6种景观植物石楠、女贞、木樨、樟树、卫矛冬青和荷花玉兰的叶片中共分离13株高效好氧反硝化细菌,其中女贞3株、石楠2株、荷花玉兰2株、卫矛冬青1株、木樨2株和樟树3株。对13株细菌进行了DNA提取、16S rRNA基因测序、序列分析。结果显示,来自景观植物叶际的13株好氧反硝化细菌分属于4个不同的门[拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)];7个不同的科[鞘氨醇杆菌科(Sphingobacteriaceae)、产碱杆菌科(Alcaligenaceae)、假单胞菌科(Pseudomonadaceae)、奈瑟氏菌科(Neisseriaceae)、微球菌科(Micrococcaceae)、肠杆菌科(Enterobacteriaceae)和微杆菌科(Microbacteriaceae)];7个不同的属[鞘氨醇杆菌属(Sphingobacterium[40])、无色杆菌属(Achromobacter[41])、假单胞菌属(Pseudomonas[25, 42-44])、假节杆菌属(Pseudarthrobacter[45])、不动杆菌属(Acinetobacter[35, 46-48])、肠杆菌属(Enterobacter[28, 49-50])和微杆菌属(Microbacterium[51])],表 1列出16株好氧反硝化细菌,其中3株来源于景观林区的土壤中,作为筛选过程中的对照样品。本研究从6种景观植物中筛选到的13株好氧反硝化细菌,分别属于4门7科7属,而且这7个属的微生物都已经被发现具有好氧反硝化功能[41-51],其中大多数是从污泥、土壤和水体的环境中分离得到的。
| Strains | Nearest phylogenetic neighbor in GenBank | Similarity (%) | Genus and species of the strains |
Isolated place | Detection of napA |
| ZF11 | Sphingobacterium mizutaii strain DSM 11724 | 96.00 | Sphingobacterium sp. | Cinnamomum camphora | + |
| ZF12 | Achromobacter insolitus strain CCUG 47057 | 97.46 | Achromobacter sp. | Cinnamomum camphora | + |
| ZF31 | Achromobacter insolitus strain CCUG 47057 | 96.79 | Achromobacter sp. | Cinnamomum camphora | + |
| MF11 | Pseudomonas furukawaii strain KF707 | 100.00 | Pseudomonas sp. | Melilotus | + |
| MF12 | Achromobacter dolens strain LMG 26840 | 100.00 | Achromobacter sp. | Melilotus | + |
| WF11 | Acinetobacter radioresistens strain NBRC 102413 | 95.86 | Acinetobacter sp. | Euonymus alatus | + |
| TF12 | Achromobacter insolitus strain LMG 6003 | 99.52 | Achromobacter sp. | Forest soil | N |
| TF13 | Cupriavidus sp. strain HBUM200019 | 97.78 | Cupriavidus sp. | Forest soil | N |
| TF31 | Pseudomonas sp. strain CMF-14 | 95.60 | Pseudomonas sp. | Forest soil | + |
| HF12 | Pseudarthrobacter oxydans strain DSM 20119 | 95.52 | Pseudarthrobacter sp. | Magnolia lotus | + |
| HF | Enterobacter hormaechei subsp. xiangfangensis strain 10-17 | 99.65 | Enterobacte sp. | Magnolia lotus | + |
| NF31 | Pseudomonas veronii strain CIP 104663 | 99.50 | Pseudomonas sp. | Ligustrum | + |
| NF32 | Enterobacter quasihormaechei strain WCHEs120003 | 99.65 | Enterobacte sp. | Ligustrum | + |
| NF | Enterobacter hormaechei strain HN18447 | 99.00 | Enterobacte sp. | Ligustrum | + |
| SF | Enterobacter cloacae strain ATCC 13047 | 99.86 | Enterobacte sp. | Photinia | + |
| SF3 | Microbacterium esteraromaticum strain DSM 8609 | 95.47 | Microbacterium sp. | Photinia | + |
| napA: Periplasmic nitrate reductase gene; +: The detection of napA gene is positive; N: Not detected. | |||||
从分析结果来看,景观植物叶际可培养的好氧反硝化细菌的多样性较好,由于所选定的景观植物种类有限,且微生物的种类与植物种类、植物生长环境、季节都有关系,因此,对于景观植物可培养好氧反硝化细菌的多样性的研究工作还需持续深入。目前对于景观植物叶际是否有好氧反硝化细菌,以及它们在叶际表面的生理功能尚无相关报道,该结果拓展了叶际好氧反硝化细菌的定殖和潜在应用范围。
2.2 菌株的反硝化效率测定对12种好氧反硝化细菌的反硝化效率测定结果如图 1所示。从定量实验结果上看,菌株ZF11、MF11、WF11和SF的硝态氮去除率较高,均在80%以上,以硝态氮的去除率指标为标准,筛选出菌株WF11和SF,并对其反硝化特性进行深入研究。菌株WF11的16S rRNA基因与抗辐射不动杆菌(Acinetobacter radioresistens) NBRC 102413的一致性最高,且硝态氮去除率较高,叶际微生物区别于土壤微生物的一个典型特征是抗辐射性和抗逆性要好。因此,本研究选择菌株SF作为出发菌株,进而对其脱氮特性进行研究。
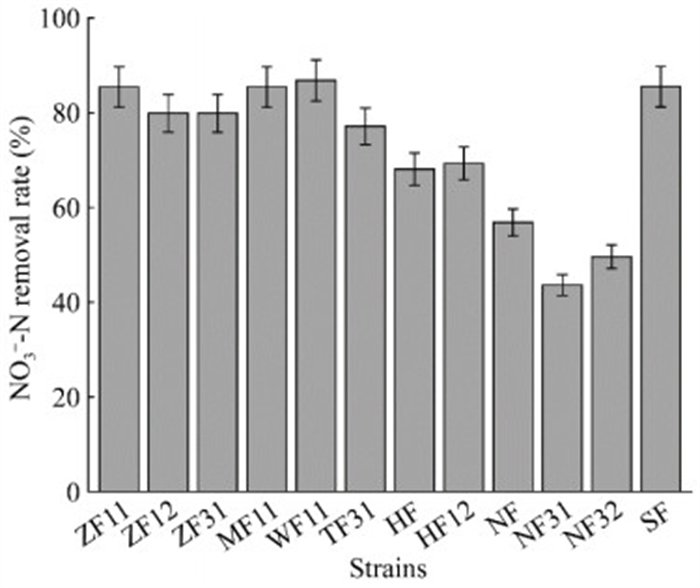
|
| 图 1 12种好氧反硝化细菌的硝酸盐去除率 Figure 1 Nitrate removal rates of 12 aerobic denitrifying bacteria. Data were expressed as the average of triplicate replica±standard deviation. |
2.3 菌株SF鉴定 2.3.1 形态学特征及部分生理生化结果
菌种SF的菌落为乳白色不透明黏稠状、表面光滑;细胞为革兰氏阴性、短杆状。菌株SF能够在以葡萄糖、蔗糖、丁二酸钠和柠檬酸钠为唯一碳源的无机盐培养基上生长良好,在LB培养基上生长状态更好,在以丁二酸钠和柠檬酸钠为唯一碳源的无机盐培养基中可以生长,但菌体浓度不高,在以甲醇、酒石酸钾钠为唯一碳源的培养基中几乎不生长。吲哚实验阴性、甲基红实验阴性、V-P试验阳性。其形态学特征与生理生化特征与《常见细菌系统鉴定手册》[26]中所述的肠杆菌属中的阴沟肠杆菌特征一致。
2.3.2 分子生物学鉴定结果扩增得到的菌株SF部分16S rRNA基因长1 413 bp,经测序及其同源性分析,菌株SF与阴沟肠杆菌(Enterobacter cloacae) ATCC 13047的一致性最高,达到99.86%,且在系统发育树上聚为一支。结合形态特征、部分生理生化特性以及16S rRNA基因的同源性分析,表明该菌株为肠杆菌属(Enterobacter),且可能为肠杆菌属中的阴沟肠杆菌(Enterobacter cloacae)。
张进等[50]证实该实验室保藏的阴沟肠杆菌(Enterobacter cloacae) F2具有良好的异养硝化-好氧反硝化能力,对于高C/N含Cu2+污水可以表现良好的处理效果。Padhi等[49]从生活污水中分离出一株异养细菌阴沟肠杆菌(Enterobacter cloacae) CF-S27,该菌株在高浓度羟胺存在下同时表现出硝化和需氧的反硝化作用。Zhao等[28]从城市污水处理厂的活性污泥中分离出阴沟肠杆菌(Enterobacter cloacae) HNR,当NO3−-N浓度为200、300和500 mg/L时,该菌株对NO₃⁻-N的去除率分别为83.0%、74.5%和75.0%,具有较好的反硝化脱氮能力,他们还从该菌株扩增出napA基因。
参考了Zhao等[28]的方法也从SF菌株中成功扩增出与脱氮作用有关的关键基因硝酸还原酶基因napA,该基因大小为880 bp左右,与预期大小一致(图 2)。这些结果表明筛选出的菌株SF也可能具有好氧反硝化特性,符合预期筛选结果。
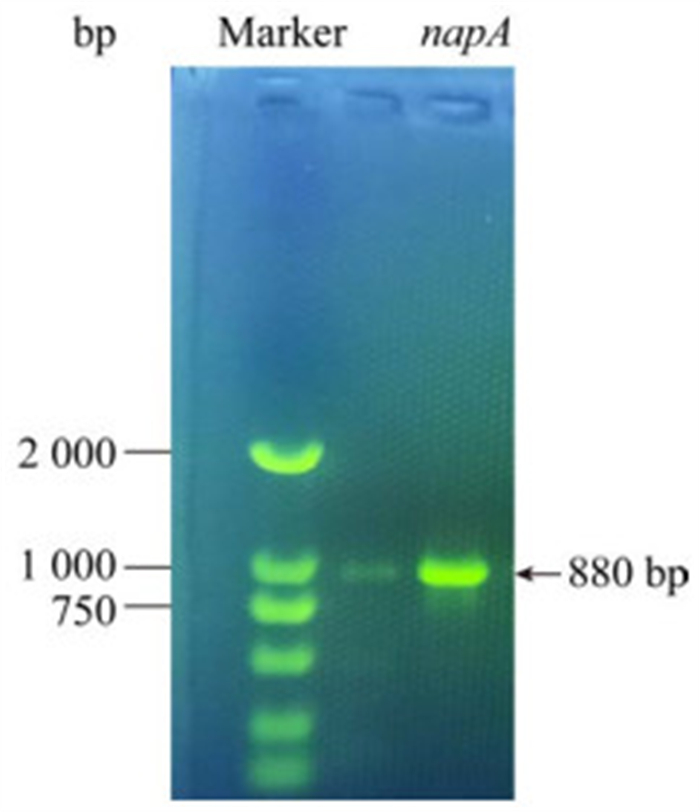
|
| 图 2 周质硝酸盐还原酶基因napA的PCR检测结果 Figure 2 The detection of napA gene by PCR. |
napA基因编码的周质硝酸还原酶(periplasmic nitrate reductase, NAP)催化NO₃⁻-N还原为NO₂⁻-N,是好氧反硝化途径的关键酶。将来源于菌株SF的napA基因和其余6株好氧反硝化细菌的napA基因与GenBank上公布的4株菌的napA基因进行比较并作了系统发育分析(图 3)。结果显示,从无色杆菌属(Achromobacter)的菌株Z12、Z31、M12和不动杆菌属(Acinetobacter)的菌株W11以及假单胞菌属(Pseudomonas)的菌株M11中扩增出的napA基因序列高度一致,聚在同一分支上;来自肠杆菌属(Enterobacter)的菌株SF与已公布的肠杆菌(Enterobacter sp.) (MT197112.1)亲缘关系最近,且与假单胞菌(Pseudomonas sp.) (AY515307.1, MK217475.1)聚在一个大的分支里。从假节杆菌属(Pseudarthrobacter)的菌株H12中扩增出的napA基因序列与其他几株菌株的napA基因序列差异较大,进化关系较远。Zhao等[28]对阴沟肠杆菌(Enterobacter cloacae) HNR的napA基因的系统发育分析结果显示,其与来源于门多萨假单胞菌(Pseudomonas mendocina) LerA1的napA基因序列聚类到同一分支上,具有高度的一致性,这与我们的结果较为符合。从细菌的分类学分析,无色杆菌属(Achromobacter)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和肠杆菌属(Enterobacter)都属于变形菌门,形态结构和生态功能较为相近,因而它们的功能基因napA基因序列一致性较高;而假节杆菌属(Pseudarthrobacter)属于放线菌门,因此H12的napA基因序列与其他几株细菌的差异较大,进化关系较远。

|
| 图 3 基于邻接法的周质硝酸还原酶基因napA的系统发育树 Figure 3 Phylogenetic analysis by neighbor-joining method based on nitrate reductase genes. The numbers in the brackets are accession numbers of napA gene in National Microbiology Data Center (Z12, Z31, M11, W11, SF, H12, M12) or GenBank (Y2-1-1, LerA1, HNR). Values at branch nodes represent bootstrap values. The length of branch represents the evolutionary distance and the coefficient is 0.05. |
2.3.3 功能学鉴定结果
由NAP酶催化,使硝酸态氮向亚硝态氮转变是好氧反硝化反过程的关键一步[29]。由图 4可知,随菌株SF的生长,培养基中硝酸态氮含量降低,亚硝态氮先升高后降低,可能是起始NAP酶活性较强使硝酸态向亚硝态氮转变,造成亚硝态氮的积累,随着亚硝酸盐还原酶活性增强,亚硝态氮又被去除。实验结果从功能学的角度验证菌株SF具备反硝化功能。
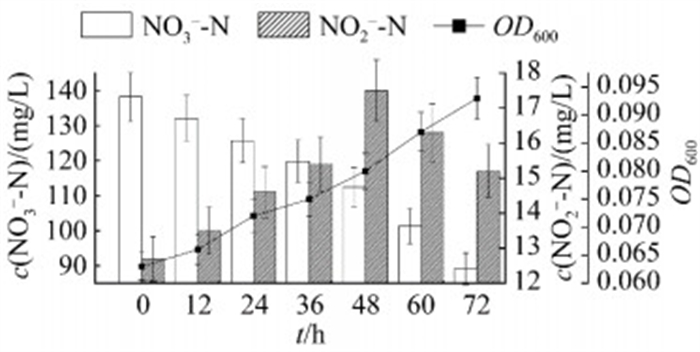
|
| 图 4 菌株SF的反硝化特性 Figure 4 The denitrification performance of strain SF. Data were expressed as the average of triplicate replica±standard deviation. |
2.4 单因素试验结果 2.4.1 碳源对菌株SF脱氮效率的影响
碳源对微生物生长有着重要意义,主要的碳源有糖类、小分子有机酸、醇类等[29],如图 5A、5B所示,该菌株SF在糖类物质中,具有较快的生长量和生长速度,反硝化效率也较好。其中在蔗糖中72 h总氮去除率达到91.22%,在葡萄糖中达到92.80%。而在小分子有机酸中如图 5C、5D所示,丁二酸钠仅为71.69%,柠檬酸钠为61.42%,值得注意的是,当使用小分子酸时,细菌的生长与脱氮效果并不一致,可能在小分子有机酸作碳源时,微生物把氮源更多地用于反硝化途径。如图 5E、5F所示,在酒石酸钾钠和甲醇中微生物几乎不生长。因此,采用葡萄糖作为后续实验中最合适的碳源。
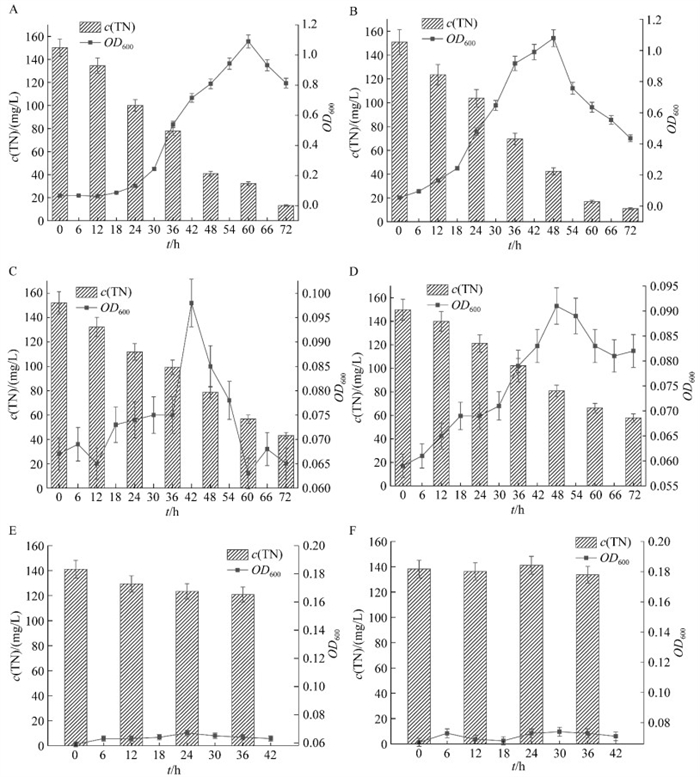
|
| 图 5 不同碳源蔗糖(A)、葡萄糖(B)、丁二酸钠(C)、柠檬酸钠(D)、酒石酸钾钠(E)、甲醇(F)对菌株SF脱氮效率的影响 Figure 5 Effect of different carbon sources sucrose (A), glucose (B), sodium succinate (C), sodium citrate (D), potassium sodium tartrate (E), methanol (F) on the nitrogen removal of strain SF. Data were expressed as the average of triplicate replica±standard deviation. |
2.4.2 C/N对菌株脱氮效率的影响
碳源与氮源的供应比值对微生物的生长有着重要意义,如图 6所示,随着C/N从3增加到15,菌株SF的脱氮效率先升高或降低,在C/N为8时最高为93.04%。而C/N为3时,去除率仅达到55.74%。Zhao等[52]的研究表明,好氧反硝化菌最佳C/N在10−15之间,适当提高C/N有利于好氧反硝化过程的进行;Jia等[53]在研究菌株DQ01时发现,该菌株的最佳C/N为7.5,对总氮的去除率为94.21%,均与本研究结论较为相似。
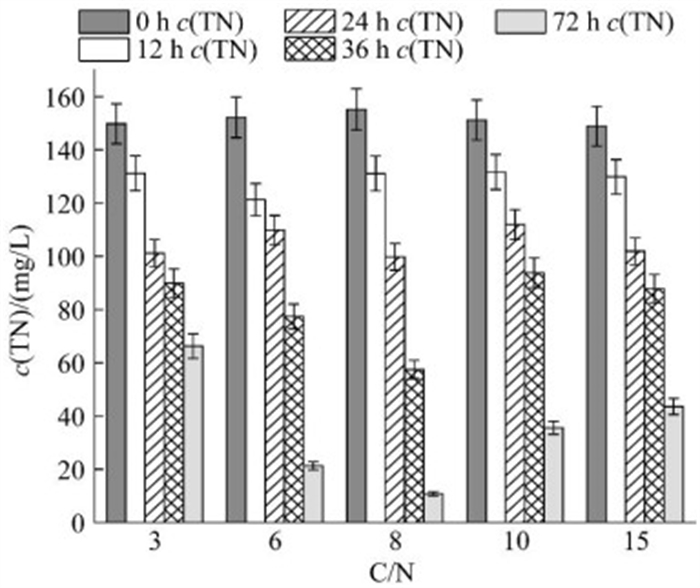
|
| 图 6 不同C/N下的脱氮效率 Figure 6 The nitrogen removal at different C/N ratios. Data were expressed as the average of triplicate replica±standard deviation. |
2.4.3 pH对菌株脱氮效率的影响
培养基初始pH对菌株进行好氧反硝化有重要意义,pH不仅影响酶的活性,在反硝化过程中会产氢,也会对反硝化过程造成影响。如图 7所示,菌株SF在pH值为7.0−8.0时,脱氮效率达到最大为93.50%,该菌株在pH值为7.0−8.0的中碱性环境中表现出了最优脱氮性能,这与谷氨酸杆菌属(Glutamicibacter sp.) WS1的最佳脱氮pH值范围相近[54]。验证了该菌种在中性偏碱性的环境中有着更强的生理活性。Zheng等[44]发现施氏假单胞菌(Pseudomonas stutzeri) PCN-1对酸性环境敏感,在pH为6.0的条件中反硝化效率低下,但对碱性环境具有一定的耐受性。
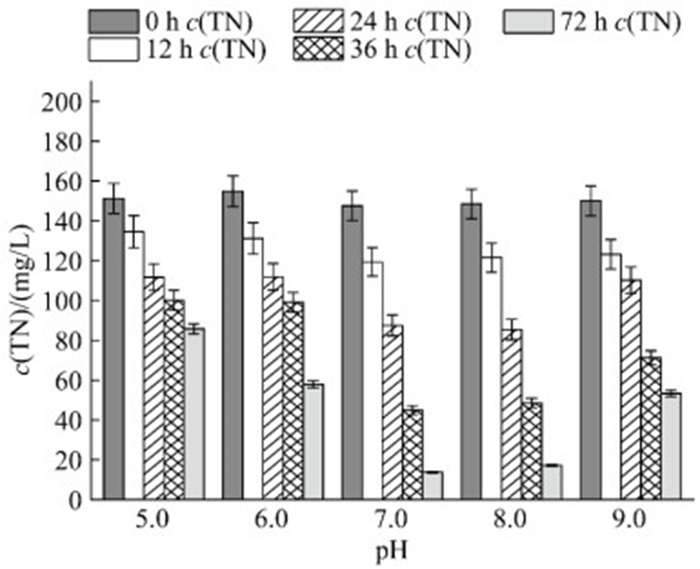
|
| 图 7 不同pH下的脱氮效率 Figure 7 The nitrogen removal at different pH. Data were expressed as the average of triplicate replica±standard deviation. |
2.4.4 溶解氧对菌株脱氮效率的影响
摇床的转速反映了摇瓶中溶解氧的浓度。研究表明,氧的增加可以加速氧气和硝酸盐氮之间的传质效率,增强菌株与底物的接触,从而提高脱氮效率[54-55]。如图 8所示,随着转速逐步地提高,培养基中溶氧量随之提高,菌株SF的脱氮效率逐步提高,在180 r/min时,菌株的72 h脱氮效率达到了92.10%。
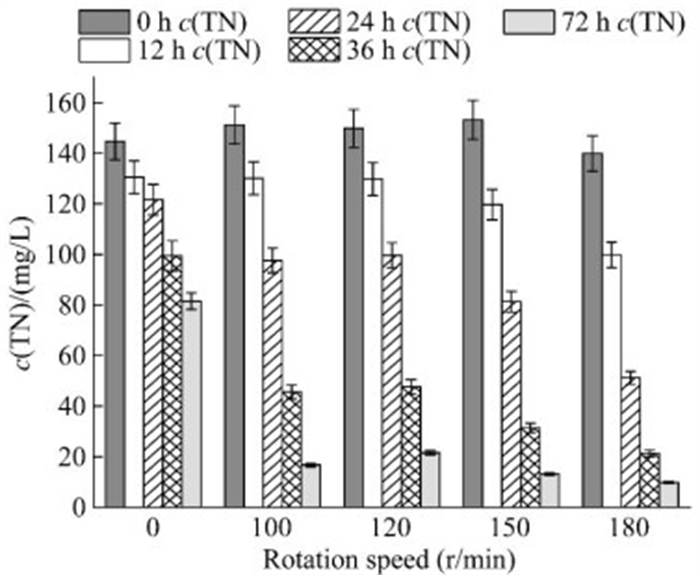
|
| 图 8 不同转速下的脱氮效率 Figure 8 The nitrogen removal at different rotational speeds. Data were expressed as the average of triplicate replica±standard deviation. |
2.4.5 温度对菌株脱氮效率的影响
一般情况下,温度是影响好氧反硝化的一个重要因素。在不同的温度下,微生物的流动性、生物大分子的活力都会发生变化,从而对微生物的生命行为产生一定的影响,温度过高和过低都会对好氧反硝化过程的发挥作用的酶的活性造成影响[17]。如图 9所示,在25 ℃下菌株的脱氮率仅为64.08%,在35 ℃时达到最大为92.22%,在40 ℃时菌株活性又受到抑制,脱氮效率降为69.60%。
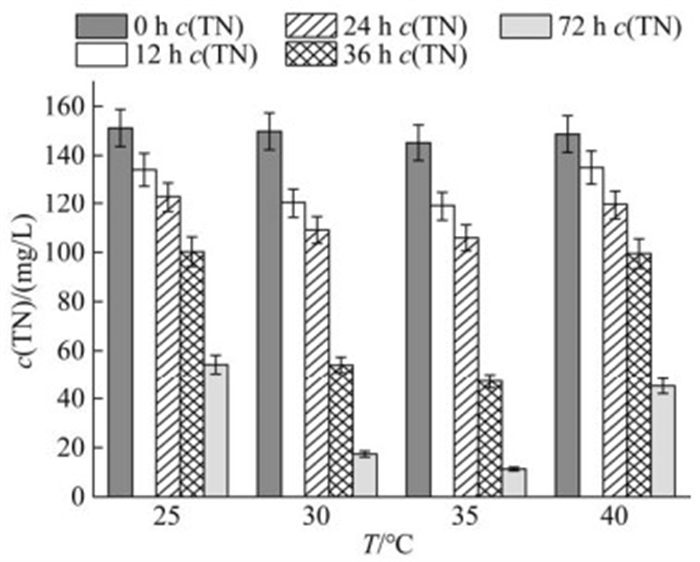
|
| 图 9 不同温度下的脱氮效率 Figure 9 The nitrogen removal at different temperatures. Data were expressed as the average of triplicate replica±standard deviation. |
单因素试验结果显示,菌株SF在碳源为葡萄糖,KNO3为唯一氮源的液体培养基中,当C/N为8,摇床转速为180 r/min,温度为35 ℃,脱氮效率最优。
2.5 响应面实验分析根据以上单因素试验对菌株SF脱氮能力的分析结果,确定响应面试验的因素和水平,采用Box-Behnken中心组合进行三因素三水平的响应面设计。利用软件Design Expert 13.0对实验结果进行分析拟合,得出在最大去除率时各因素的最佳值:pH为7.5,温度为33.5 ℃,C/N为9.7时,在72 h的脱氮效率为93.3%。根据以上分析的结果,用最佳条件和另外随机选取了2组预测结果进行验证实验。结果显示预测值与实际值的差异很小(相对误差在2.62%以内),这表明预测模型能够准确地反映各种因素对菌株SF脱氮效率的影响。
3 讨论与结论从6种景观植物石楠、女贞、木樨、樟树、卫矛冬青和荷花玉兰的叶际中分离到好氧反硝化细菌13株,经16S rRNA基因测序及序列分析,13株菌分别属于4门(拟杆菌门、放线菌门、变形菌门和厚壁菌门) 7科7属,其中4株为肠杆菌属,3株为无色杆菌属,2株为假单胞菌属,其余4株分别属于鞘氨醇杆菌属、不动杆菌属、假节杆菌属和微杆菌属。结果提示植物叶际存在着种类丰富的可培养的好氧反硝化细菌。
这个结果初步支持了关于叶际微生物协同削减大气氮氧化物机制的假设:大气中的氮氧化物溶解于叶面的水膜形成的硝酸盐和来源于微颗粒物中的可溶性硝酸盐成为叶面硝酸盐利用菌或反硝化细菌的氮源,其中的一部分可以通过叶际微生物的反硝化途径将硝酸盐还原为无害氮气释放到空气中,从而达到协同植物削减大气氮氧化物的目的。这为研究叶际微生物协同消减大气氮氧化物污染的机制提供了新的思路。
自1983年报道第一株好氧反硝化细菌以来,已分离得到超过50个属的好氧反硝化细菌,主要来源于湿地、水库、土壤、湖泊沉积物、污废水、活性污泥和池塘[17],但来源于景观植物的好氧反硝化细菌鲜有报道。王永霞等[20]从滇池沉积物和水体样品中分离出260株好氧反硝化细菌,经16S rRNA基因序列分析,260株菌分属于2个门(变形菌门、厚壁菌门) 13科14属59种,其中假单胞菌属为优势属,菌株数量占总细菌数量的46.9%,其次是不动杆菌属,占21.2%。张明霞[56]从不同养殖水体的60份样本中分离筛选获得潜在好氧反硝化细菌714株,分布于4个门(变形菌门、放线菌门、拟杆菌门和厚壁菌门),假单胞菌属为优势属,菌株数量占总细菌数量的33.8%,其次为无色杆菌属,占10.5%。本研究从6种植物的叶际分离到的13株好氧反硝化细菌却归属于4个门,这表明在叶际可能存在着丰富多样的不同于水生环境的好氧反硝化细菌及硝酸盐还原酶基因资源,值得进一步深入挖掘和研究。由于本研究所选的景观植物种类有限,筛选的叶际好氧反硝化细菌资源有限,对于景观植物可培养好氧反硝化细菌的多样性的研究工作还需持续深入。
从筛选方法上来看,张明霞[56]使用反硝化选择培养基初筛后,直接采用菌落PCR的方法,使用细菌通用引物27F/1492R对初筛的单菌落进行16S rRNA基因序列扩增和种属鉴定,并依据该结果分析获得菌株资源的物种分布,因而其获得的只是潜在的好氧反硝化细菌资源;王永霞等[20]则是采用富集培养结合BTB培养基筛选和格里斯试剂复筛的方法获得菌株资源;本研究除了使用格里斯试剂初筛和BTB培养基复筛的方法,还通过对反硝化途径的关键基因napA的扩增,对筛选到的好氧反硝化菌株进行功能基因水平上的确认,其筛选结果的可靠程度更高。
此外,叶际微生物的固氮作用[9-10]已较多地被研究,但叶际微生物的反硝化作用尚鲜有报道。本研究已发现叶际含有多样的好氧反硝化细菌,但这些好氧反硝化细菌能把多大比例的叶际硝酸盐通过反硝化途径转化为N2排放到空气中?与土壤的反硝化作用相比,叶际微生物的反硝化作用在自然界的氮循环中所占的比例能否被忽略?这些研究内容都值得关注。
从景观植物石楠叶面分离出一株具有高效反硝化能力的菌株SF,结合形态特征、生理生化特性以及16S rRNA基因的同源性分析,表明该菌株为肠杆菌属,且与阴沟肠杆菌(Enterobacter cloacae) ATCC 13047的一致性最高,达到99.86%。通过单因素因素试验可知菌株SF脱氮的最适碳源为葡萄糖,最适宜C/N为8,最适转速为180 r/min,最佳反硝化温度为35 ℃。利用响应面分析方法进一步探究多因素对菌株SF好氧反硝化能力的影响,结果表明菌株SF最佳的脱氮条件为初始pH值为7.5,C/N为9.7,转速180 r/min,温度33.5 ℃,在此条件下,当培养基中初始硝酸盐浓度为361 mg/L时,72 h脱氮率可达到93.3%,说明该菌株有较好的脱氮能力,有一定的应用潜力。
叶际由于直接暴露于大气中,生活在叶际内的微生物经常遭受营养不良、干旱、紫外线辐射、高温、冷冻等不良环境的胁迫[8]。叶际好氧反硝化细菌SF已经被证实在实验室条件下具有反硝化作用,北方城市冬天比较寒冷,冬季日平均气温都处于冰点上下,此时,在户外裸露的叶际好氧反硝化细菌是否仍然能够起到反硝化作用,值得关注。研究表明,低温会抑制酶的活性从而减缓细菌的生长速度,同延迟好氧反硝化途径中关键基因的表达[57],从而降低好氧反硝化细菌的脱氮效率,因而筛选耐低温的好氧反硝化细菌是提高低温条件下污染废水脱氮效果的重要途径之一[58]。董怡华等[59]从寒冷地区的河水底泥中分离到一株气单胞菌(Aeromonas sp.) Z6,在12 ℃时对硝酸盐氮的60 h去除率可以达到89.72%。杨倩[60]从高山冻土样品中分离得了一株耐冷简单芽孢杆菌(Bacillus simplex) H-b,在5 ℃时培养168 h对培养基中的硝酸盐氮的去除率可以达到40.07%。这些研究为北方地区低温废水的生物脱氮提供了菌种资源,也为研究低温环境中叶际反硝化细菌的生理功能提供了经验借鉴。低温条件下,叶际反硝化细菌是否能够正常发挥作用,如何发挥作用?挖掘叶际特殊的好氧反硝化细菌资源(耐辐射、耐高温、耐低温等),研究不同环境条件下处于优势地位的好氧反硝化细菌的群落特征,将为叶际好氧反硝化细菌在实践中的应用建立工作基础。
| [1] |
王军霞, 李曼, 敬红, 吕卓. 我国氮氧化物排放治理状况分析及建议[J]. 环境保护, 2020, 48(18): 24-27.
WANG JX, LI M, JING H, LÜ Z. Analysis and suggestions on nitrogen oxide emission control in China[J]. Environmental Protection, 2020, 48(18): 24-27 (in Chinese). |
| [2] |
GONG C. Purification function of plants for nitrogen oxides in urban air: a study based on stable isotope method[D]. Hefei: Doctoral Dissertation of University of Science and Technology of China, 2020 (in Chinese). 龚诚. 植物对城市空气氮氧化物的净化功能: 基于稳定同位素方法的研究[D]. 合肥: 中国科学技术大学博士学位论文, 2020. |
| [3] | GONG C, XIAN CF, SU YB, OUYANG ZY. Estimating the nitrogen source apportionment of Sophora japonica in roadside green spaces using stable isotope[J]. The Science of the Total Environment, 2019, 689: 1348-1357 DOI:10.1016/j.scitotenv.2019.06.408. |
| [4] | VORHOLT JA. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology, 2012, 10: 828-840 DOI:10.1038/nrmicro2910. |
| [5] | LINDOW SE, BRANDL MT. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology, 2003, 69(4): 1875-1883 DOI:10.1128/AEM.69.4.1875-1883.2003. |
| [6] | LINDOW SE, LEVEAU JHJ. Phyllosphere microbiology[J]. Current Opinion in Biotechnology, 2002, 13(3): 238-243 DOI:10.1016/S0958-1669(02)00313-0. |
| [7] | REDFORD AJ, BOWERS RM, KNIGHT R, LINHART Y, FIERER N. The ecology of the phyllosphere: geographic and phylogenetic variability in the distribution of bacteria on tree leaves[J]. Environmental Microbiology, 2010, 12(11): 2885-2893 DOI:10.1111/j.1462-2920.2010.02258.x. |
| [8] |
吴松, 周甜, 杨立宾, 江云兵, 潘虹, 刘永志, 杜君. 基于VOSviewer的叶际微生物研究现状可视化分析[J]. 中国农学通报, 2023, 39(1): 142-150.
WU S, ZHOU T, YANG LB, JIANG YB, PAN H, LIU YZ, DU J. VOS viewer-based visual analysis on research status of phyllosphere microorganisms[J]. Chinese Agricultural Science Bulletin, 2023, 39(1): 142-150 (in Chinese). |
| [9] |
沙小玲, 梁胜贤, 庄绪亮, 韩庆莉, 白志辉. 植物叶际固氮菌研究进展[J]. 微生物学通报, 2017, 44(10): 2443-2451.
SHA XL, LIANG SX, ZHUANG XL, HAN QL, BAI ZH. Nitrogen-fixing bacteria in the phyllosphere[J]. Microbiology China, 2017, 44(10): 2443-2451 (in Chinese). |
| [10] | ZHU YG, PENG JJ, CHEN C, XIONG C, LI SL, GE AH, WANG ET, LIESACK W. Harnessing biological nitrogen fixation in plant leaves[J]. Trends in Plant Science, 2023, 28(12): 1391-1405 DOI:10.1016/j.tplants.2023.05.009. |
| [11] | HE YH, ADKAR-PURUSHOTHAMA CR, ITO T, SHIRAKAWA A, YAMAMOTO H, KASHIWAGI A, TATEWAKI A, FUJIBAYASHI M, SUGIYAMA S, YAGINUMA K, AKAHIRA T, YAMAMOTO S, TSUSHIMA S, MATSUSHITA Y, SANO T. Microbial diversity in the phyllosphere and rhizosphere of an apple orchard managed under prolonged "natural farming" practices[J]. Microorganisms, 2021, 9(10): 2056 DOI:10.3390/microorganisms9102056. |
| [12] | CHEN T, NOMURA K, WANG XL, SOHRABI R, XU J, YAO LY, PAASCH BC, MA L, KREMER J, CHENG YT, ZHANG L, WANG N, WANG ET, XIN XF, HE SY. A plant genetic network for preventing dysbiosis in the phyllosphere[J]. Nature, 2020, 580: 653-657 DOI:10.1038/s41586-020-2185-0. |
| [13] | XU NH, QU Q, ZHANG ZY, YUAN WT, CUI HZ, SHEN YJ, LIN W, LU T, QIAN HF. Effects of residual S-metolachlor in soil on the phyllosphere microbial communities of wheat (Triticum aestivum L.)[J]. The Science of the Total Environment, 2020, 748: 141342 DOI:10.1016/j.scitotenv.2020.141342. |
| [14] | LIU JY, SONG MJ, WEI XY, ZHANG HZ, BAI ZH, ZHUANG XL. Responses of phyllosphere microbiome to ozone stress: abundance, community compositions and functions[J]. Microorganisms, 2022, 10(4): 680 DOI:10.3390/microorganisms10040680. |
| [15] |
杨丽, 何腾霞, 张漫漫, 杨露. 好氧反硝化细菌碳氮代谢特点及途径的研究进展[J]. 微生物学报, 2022, 62(12): 4781-4797.
DOI:10.13343/j.cnki.wsxb.20220254 YANG L, HE TX, ZHANG MM, YANG L. Research progress in the characteristics and pathways of carbon and nitrogen metabolism of aerobic denitrifying bacteria[J]. Acta Microbiologica Sinica, 2022, 62(12): 4781-4797 (in Chinese). |
| [16] | ROBERTSON LA, KUENEN JG. Aerobic denitrification—old wine in new bottles?[J]. Antonie Van Leeuwenhoek, 1984, 50(5): 525-544. |
| [17] |
白洁, 陈琳, 黄潇, 胡春辉, 赵阳国, 李岿然. 1株耐盐异养硝化-好氧反硝化菌Zobellella sp. B307的分离及脱氮特性[J]. 环境科学, 2018, 39(10): 4793-4801.
BAI J, CHEN L, HUANG X, HU CH, ZHAO YG, LI KR. Isolation and nitrogen removal characteristics of salt-tolerant heterotrophic nitrification and aerobic denitrification bacteria Zobellella sp. B307[J]. Environmental Science, 2018, 39(10): 4793-4801 (in Chinese). |
| [18] |
SHI YJ. Study on nitrogen removal characteristics and population structure of aerobic denitrifying bacteria in reservoirs[D]. Xi'an: Master's Thesis of Xi'an University of Architecture and Technology, 2022 (in Chinese). 史印杰. 水库好氧反硝化细菌脱氮特性与种群结构研究[D]. 西安: 西安建筑科技大学硕士学位论文, 2022. |
| [19] | GUO LY, CHEN QK, FANG F, HU ZX, WU J, MIAO AJ, XIAO L, CHEN XF, YANG LY. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water[J]. Bioresource Technology, 2013, 142: 45-51 DOI:10.1016/j.biortech.2013.05.021. |
| [20] |
王永霞, 霍晴晴, 李亚平, 肖炜, 赖泳红, 和树庒, 崔晓龙. 滇池可培养好氧反硝化细菌多样性及其脱氮特性[J]. 微生物学报, 2018, 58(10): 1764-1775.
DOI:10.13343/j.cnki.wsxb.20170586 WANG YX, HUO QQ, LI YP, XIAO W, LAI YH, HE SZ, CUI XL. Diversity and nitrogen removal efficiency of culturable aerobic denitrifying bacteria in the sediment and water in Dianchi Lake[J]. Acta Microbiologica Sinica, 2018, 58(10): 1764-1775 (in Chinese). |
| [21] |
王月, 滕志远, 张秀丽, 车延辉, 孙广玉. 大气NO2影响植物生长与代谢的研究进展[J]. 应用生态学报, 2019, 30(1): 316-324.
WANG Y, TENG ZY, ZHANG XL, CHE YH, SUN GY. Research prowess on the effects of atmospheric nitrogen dioxide on plant growth and metabolism[J]. Chinese Journal of Applied Ecology, 2019, 30(1): 316-324 (in Chinese). |
| [22] |
周敏, 陈长虹, 王红丽, 黄成, 苏雷燕, 陈宜然, 李莉, 乔月珍, 陈明华, 黄海英, 张钢锋. 上海市秋季典型大气高污染过程中颗粒物的化学组成变化特征[J]. 环境科学学报, 2012, 32(1): 81-92.
ZHOU M, CHEN CH, WANG HL, HUANG C, SU LY, CHEN YR, LI L, QIAO YZ, CHEN MH, HUANG HY, ZHANG GF. Chemical characteristics of particulate matters during air pollution episodes in autumn of Shanghai, China[J]. Acta Scientiae Circumstantiae, 2012, 32(1): 81-92 (in Chinese). |
| [23] |
LIU SG. Isolation, identification and characteristic of an aerobic denitrifying bacteria with high nitrogen removal efficiency[D]. Qufu: Master's Thesis of Qufu Normal University, 2018 (in Chinese). 刘胜格. 高效好氧反硝化细菌的筛选、鉴定及其脱氮性能的研究[D]. 曲阜: 曲阜师范大学硕士学位论文, 2018. |
| [24] |
常允康, 贾莹莹, 王丽华, 王涵, 樊惠原, 居润成, 徐娜. 一株好氧反硝化芽孢杆菌的筛选鉴定及脱氮特性研究[J]. 山东农业大学学报(自然科学版), 2022, 53(6): 819-824.
CHANG YK, JIA YY, WANG LH, WANG H, FAN HY, JU RC, XU N. Screening and identification of an aerobic denitrification Bacillus strain and its nitrogen removal characteristics[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2022, 53(6): 819-824 (in Chinese). |
| [25] |
胡金星, 汤江武, 王新, 姚晓红, 吴逸飞, 葛向阳. 一株反硝化细菌的鉴定、功能基因检测及其反硝化特性[J]. 环境科学与技术, 2012, 35(12): 27-32.
HU JX, TANG JW, WANG X, YAO XH, WU YF, GE XY. Study on a denitrifier strain: its identification, functional genes detection and denitrification characteristics[J]. Environmental Science & Technology, 2012, 35(12): 27-32 (in Chinese). |
| [26] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 294-348.
DONG XZ, CAI MY. Handbook of Identification of Common Bacterial Systems[M]. Beijing: Science Press, 2001: 294-348 (in Chinese). |
| [27] |
一株甲醇利用菌的分离、鉴定及特性研究[J]. 中国酿造, 2021, 40(5): 140-146.
Isolation, identification and growth characterization of a strain of methanol- utilizing bacteria[J]. China Brewing, 2021, 40(5): 140-146 (in Chinese). |
| [28] | Characterization of an aerobic denitrifier Enterobacter cloacae strain HNR and its nitrate reductase gene[J]. Archives of Microbiology, 2020, 202(7): 1775-1784 DOI:10.1007/s00203-020-01887-y. |
| [29] |
YUAN HL. Cloning and function of key enzymes of aerobic denitrification pathway[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2016 (in Chinese). 袁会兰. 好氧反硝化途径关键酶基因克隆与功能研究[D]. 北京: 中国农业科学院硕士学位论文, 2016. |
| [30] |
LIU FJ. Screening of an efficient heterotrophic nitrification-aerobic denitrification bacterium WZ17 and its denitrification characteristics[D]. Wenzhou: Master's Thesis of Wenzhou University, 2019 (in Chinese). 刘方剑. 一株高效异养硝化: 好氧反硝化细菌WZ17的筛选及其脱氮特性研究[D]. 温州: 温州大学硕士学位论文, 2019. |
| [31] | Heterotrophic nitrification and aerobic denitrification process: promising but a long way to go in the wastewater treatment[J]. The Science of the Total Environment, 2022, 805: 150212 DOI:10.1016/j.scitotenv.2021.150212. |
| [32] | Intensified nitrogen removal by heterotrophic nitrification aerobic denitrification bacteria in two pilot-scale tidal flow constructed wetlands: influence of influent C/N ratios and tidal strategies[J]. Bioresource Technology, 2020, 302: 122803 DOI:10.1016/j.biortech.2020.122803. |
| [33] | Regulation of dissolved oxygen from accumulated nitrite during the heterotrophic nitrification and aerobic denitrification of Pseudomonas stutzeri T13[J]. Applied Microbiology and Biotechnology, 2015, 99(7): 3243-3248 DOI:10.1007/s00253-014-6221-6. |
| [34] | Nitrogen removal capability through simultaneous heterotrophic nitrification and aerobic denitrification by Bacillus sp. LY[J]. Environmental Technology, 2010, 31(4): 409-416 DOI:10.1080/09593330903508922. |
| [35] |
贫营养好氧反硝化菌株的脱氮特性及氮/碳平衡分析[J]. 环境科学, 2020, 41(5): 2339-2348.
Nitrogen removal performance and nitrogen/carbon balance of oligotrophic aerobic denitrifiers[J]. Environmental Science, 2020, 41(5): 2339-2348 (in Chinese). |
| [36] |
响应面法优化γ-聚谷氨酸发酵条件[J]. 中国调味品, 2015, 40(7): 56-60.
Optimization of fermentation conditions for γ-PGA with response surface method[J]. China Condiment, 2015, 40(7): 56-60 (in Chinese). |
| [37] |
State Environmental Protection Administration, Standardization Administration of the People's Republic of China. Determination of nitrate nitrogen in water by Ultraviolet spectrophotometry (Trial), HJ/T 346—2007[S]. Beijing: Standards Press of China, 2007 (in Chinese). 水质硝酸盐氮的测定紫外分光光度法(试行): 标准号: HJ/T 346—2007[S]. 北京: 中国标准出版社, 2007. |
| [38] |
State Environmental Protection Administration of the People's Republic of China. Water quality; Determination of nitrogen (nitrite); Spectrophotometric method: GB 7493—1987[S]. Beijing: Standards Press of China, 1987 (in Chinese). 国家环境保护总局. 水质亚硝酸盐氮的测定分光光度法: GB 7493—1987[S]. 北京: 中国标准出版社, 1987. |
| [39] |
State Environmental Protection Administration, Standardization Administration of the People's Republic of China. Determination of total nitrogen in water quality, alkaline potassium persulfate digestion, ultraviolet spectrophotometry, HJ 636—2012[S]. Beijing: Standards Press of China, 2012 (in Chinese). 国家环境保护总局, 中国国家标准化管理委员会. 水质-总氮的测定-碱性过硫酸钾消解紫外分光光度法, HJ 636—2012[S]. 北京: 中国标准出版社, 2012. |
| [40] |
鞘氨醇单胞菌的研究进展[J]. 微生物学通报, 2023, 50(6): 2738-2752.
Research progress of Sphingomonas[J]. Microbiology China, 2023, 50(6): 2738-2752 (in Chinese). |
| [41] |
LU XY. Study on heterotrophic nitrification-aerobic denitrification efficiency of Achromobacter denitrificans[D]. Lanzhou: Master's Thesis of Lanzhou Jiatong University, 2018 (in Chinese). 卢晓燕. 一株Achromobacter denitrificans的异养硝化-好氧反硝化脱氮效能研究[D]. 兰州: 兰州交通大学硕士学位论文, 2018. |
| [42] |
一株高效好氧反硝化细菌的分离鉴定及脱氮性能研究[J]. 生物技术通报, 2019, 35(9): 202-209.
Isolation and identification of an efficient aerobic denitrifying bacterium[J]. Biotechnology Bulletin, 2019, 35(9): 202-209 (in Chinese). |
| [43] |
耐冷嗜碱蒙氏假单胞菌H97的鉴定及其好氧反硝化特性[J]. 环境科学, 2018, 39(7): 3314-3320.
Identification and characterization of a hypothermic alkaliphilic aerobic denitrifying bacterium Pseudomonas monteilii strain H97[J]. Environmental Science, 2018, 39(7): 3314-3320 (in Chinese). |
| [44] | Reducing NO and N₂O emission during aerobic denitrification by newly isolated Pseudomonas stutzeri PCN-1[J]. Bioresource Technology, 2014, 162: 80-88 DOI:10.1016/j.biortech.2014.03.125. |
| [45] |
一株好氧反硝化菌的筛选鉴定与特性研究[J]. 河南理工大学学报(自然科学版), 2017, 36(3): 79-85.
Screening and characterization study on an aerobic denitrifying bacteria[J]. Journal of Henan Polytechnic University (Natural Science Edition), 2017, 36(3): 79-85 (in Chinese). |
| [46] |
异养硝化-好氧反硝化菌Acinetobacter johnsonii sp. N26的脱氮性能及代谢途径[J]. 微生物学通报, 2023, 50(4): 1374-1395.
Optimization of nitrogen removal performance and metabolic pathway of a heterotrophic nitrifying-aerobic denitrifying bacterial strain Acinetobacter johnsonii sp. N26[J]. Microbiology China, 2023, 50(4): 1374-1395 (in Chinese). |
| [47] |
好氧反硝化菌Acinetobacter sp. A2在主要环境影响条件下的NO-3去除动力学研究[J]. 东北电力大学学报, 2019, 39(4): 68-75.
Kinetics of aerobic denitrification strain Acinetobacter sp. A2 under restrictive conditions[J]. Journal of Northeast Electric Power University, 2019, 39(4): 68-75 (in Chinese). |
| [48] | Biological nitrogen and phosphorus removal by a phosphorus-accumulating bacteria Acinetobacter sp. strain C-13 with the ability of heterotrophic nitrification-aerobic denitrification[J]. Bioresource Technology, 2021, 322: 124507 DOI:10.1016/j.biortech.2020.124507. |
| [49] | Aerobic and heterotrophic nitrogen removal by Enterobacter cloacae CF-S27 with efficient utilization of hydroxylamine[J]. Bioresource Technology, 2017, 232: 285-296 DOI:10.1016/j.biortech.2017.02.049. |
| [50] |
1株耐受Cu2+好氧反硝化菌及其饥饿特性[J]. 环境科学与技术, 2018, 41(S2): 43-50.
A strain of aerobic denitrifying bacteria tolerant to Cu2+ and its starvation characteristics[J]. Environmental Science & Technology, 2018, 41(S2): 43-50 (in Chinese). |
| [51] |
WANG H, TIAN J, SUN YC. Iron matrix autotrophic denitrification microbacterium strain and application thereof: CN103232958B[P]. 2014-08-13 (in Chinese). 王弘宇, 田俊, 孙宇翀. 一株铁基质自养反硝化微杆菌及其应用: CN103232958B[P]. 2014-08-13. |
| [52] | Characteristics of a heterotrophic nitrogen removal bacterium and its potential application on treatment of ammonium-rich wastewater[J]. Bioresource Technology, 2017, 226: 46-54 DOI:10.1016/j.biortech.2016.11.120. |
| [53] | Insight into short-cut of simultaneous nitrification and denitrification process in moving bed biofilm reactor: effects of carbon to nitrogen ratio[J]. Chemical Engineering Journal, 2020, 400: 125905 DOI:10.1016/j.cej.2020.125905. |
| [54] |
高效异养硝化-好氧反硝化菌Glutamicibacter sp. WS1低温下对多种氮源的脱氮特性及氮代谢机制[J]. 环境科学, 2023, 44(9): 5006-5016.
Nitrogen removal characteristics and metabolism mechanism of high-efficiency cold-tolerant heterotrophic nitrification-aerobic denitrification bacterium Glutamicibacter sp. WS1 for various nitrogen sources at low temperature[J]. Environmental Science, 2023, 44(9): 5006-5016 (in Chinese). |
| [55] |
好氧反硝化细菌SY-D-22的分离、优化及脱氮机理[J]. 微生物学通报, 2023, 50(5): 1815-1825.
Aerobic denitrifying bacterium SY-D-22: isolation, optimization of denitrification conditions, and characterization of denitrification mechanism[J]. Microbiology China, 2023, 50(5): 1815-1825 (in Chinese). |
| [56] |
ZHANG MX. Diversity and nitrogen removal functions of the aerobic denitrifying bacteria from aquaculture water[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2022 (in Chinese). 张明霞. 养殖水体好氧反硝化细菌多样性及其脱氮功能研究[D]. 广州: 华南理工大学博士学位论文, 2022. |
| [57] | Effect of pH and temperature on denitrification gene expression and activity in Pseudomonas mandelii[J]. Applied and Environmental Microbiology, 2009, 75(12): 3903-3911 DOI:10.1128/AEM.00080-09. |
| [58] | Highly efficient nitrogen removal of a coldness-resistant and low nutrient needed bacterium, Janthinobacterium sp. M-11[J]. Bioresource Technology, 2018, 256: 366-373 DOI:10.1016/j.biortech.2018.02.049. |
| [59] |
耐低温好氧反硝化菌Aeromonas sp. 的分离鉴定及脱氮条件优化[J]. 微生物学报, 2022, 62(6): 2038-2052.
DOI:10.13343/j.cnki.wsxb.20220158 Isolation and identification of a cold-tolerant and aerobic denitrifying bacterium Aeromonas sp. and optimization of denitrification conditions[J]. Acta Microbiologica Sinica, 2022, 62(6): 2038-2052 (in Chinese). |
| [60] |
YANG Q. Research on the aerobic denitrification and cold adaptation mechanism of a psychrotrophic Bacillus simplex[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2023 (in Chinese). 杨倩. 耐冷简单芽孢杆菌好氧反硝化脱氮及耐冷机制解析[D]. 无锡: 江南大学博士学位论文, 2023. |
 2024, Vol. 64
2024, Vol. 64




