中国科学院微生物研究所,中国微生物学会
文章信息
- 杨露, 何腾霞, 吴启凤, 杨丽. 2023
- YANG Lu, HE Tengxia, WU Qifeng, YANG Li.
- 纳米颗粒对耐冷脱氮菌及其脱氮过程的毒害调控研究进展
- Toxicity of nanoparticles to cold-adapted denitrifying bacteria and the denitrification process and the countermeasures
- 微生物学报, 63(3): 900-917
- Acta Microbiologica Sinica, 63(3): 900-917
-
文章历史
- 收稿日期:2022-07-11
- 网络出版日期:2022-10-26
氮是地球上的基本元素之一,广泛存在于自然环境和生物体中。微生物产生的相关酶类能催化无机氮和有机氮的转化,是自然界氮循环主要组成部分,但人类的干预打破了氮循环过程的平衡,导致无机氮化合物在环境中大量积累,特别是水环境中,引发水生态系统恶化[1-2]。高浓度的无机氮主要以NH4+-N、NO2–-N和NO3–-N的形式存在于水体中,造成藻类大量生长繁殖,降低水体溶解氧(dissolved oxygen, DO)浓度,加重富营养化过程,对水生植物、动物及微生物均产生毒害作用,也会通过食物链富集至人体,最终影响人体健康[3]。因此,减少排放废水中的氮含量与改善水源的生态质量是许多发达国家和发展中国家日益关注的问题。氮养分过剩也是导致我国长江口及其邻近东海(ECS)一系列环境问题的主要原因[4]。氮化合物可通过物理、化学及生物方法去除,其中生物脱氮法具有成本低、无二次污染、灵活性高等突出优势,而且随着新的氮转化微生物不断被发现,极大地丰富了氮转化的途径,使得生物脱氮技术成为去除环境中氮污染物质的重要手段之一[5]。如Miao等[6]利用生物法分类处理污染程度不同的、含有机物和高浓度NH4+-N的垃圾渗滤废水,并取得较好的效果,表明选择适当的生物脱氮工艺,可以在处理垃圾渗滤液的各个阶段实现高效除氮。温度是影响生物脱氮的一个重要环境因子,与微生物的生长繁殖和脱氮效率密切相关[7]。目前所报道的大部分脱氮功能菌的最适生长温度为20–30 ℃,当季节或区域性温度低至10 ℃以下时,会降低本地脱氮微生物的生长活性与脱氮功能,导致废水中氮污染物的处理达不到理想效果[8]。因此,研究耐冷脱氮菌如何在低温环境中进行高效脱氮具有十分重要的现实意义。耐冷菌是一类可在0–5 ℃下进行生长繁殖,最适生长温度为15 ℃以上,最高生长温度可超20 ℃的微生物[9]。目前分离获得的耐冷菌种类较多,如假单胞菌(Pseudomonas)、芽孢杆菌(Bacillus)、不动杆菌(Acinetobacter)、鞘状杆菌(grarulnmatis)、沙雷氏菌(Serratia)、节杆菌(Arthrobacter)等[10]。随着研究的不断深入,耐冷菌在低温条件下的高效脱氮方面逐渐显示出其优势。如Huang等[11]报道的耐冷菌Pseudomonas putida Y-9在15 ℃,有氧条件下可将NH4+-N直接转化为NO,进而转化为N2O,NH4+-N去除率达99.41%,且未检测到有害中间产物羟胺(NH2OH)的积累,加快了氮转化的速率。又如本研究团队分离的耐冷菌Pseudomonas taiwan J488和Glutamicibacter arylations EM-H8均具有高效除氮能力,菌株J488在初始NO3–-N约为50.0 mg/L的条件下,NO3–-N和总氮(total nitrogen, TN)去除效率分别高达100%和84.48%,菌株EM-H8在NH2OH浓度为20.0 mg/L条件下,对TN和NH2OH去除率达100%和93.75%[12-13]。
纳米颗粒(nanoparticles, NPs)是指直径小于100 nm的颗粒结构,由于其独特的性质被广泛应用于生物过程、能源设备、环境修复与医学等领域[14]。随着NPs在废水处理中使用范围的不断扩大,释放到水环境中的NPs也在不断增加;人工湿地(constructed wetlands, CW)作为生物膜处理技术广泛应用于处理含工程NPs的废水,然而,当废水进入CW后,NPs能迅速吸附到生物膜和植物的根部表面,且残留的NPs量高达90%,而NPs的长期暴露对脱氮微生物的毒害作用越发明显,不仅降低了微生物的氮转化效率,而且对水生态和人类健康也造成了不利影响[15-16]。NPs对生物的毒害作用基于细胞结构,细胞中NPs的局部浓度效应以及对氧化应激的诱导,这些可能是导致细胞损伤的原因[17]。NPs对生物氮转化过程的抑制作用范围较广,包括厌氧氨氧化、硝化、反硝化等过程[18-20]。Huang等[21]研究发现,部分NPs对耐冷脱氮菌毒害作用主要是由本身性质引起的,如NiO NPs;有的NPs毒性主要由释放的金属离子产生的,如TiO2 NPs;还有的NPs的毒性取决于其本身和释放的金属离子的共同作用,如CuO、ZnO NPs。随着对NPs影响生物氮转化过程研究的不断深入,关于NPs影响耐冷脱氮菌脱氮过程的相关研究也在不断被报道。基于耐冷微生物在低温环境中的脱氮优势,NPs又会阻碍生物脱氮过程,降低脱氮速率,因此,本文将系统论述耐冷菌的冷适应机制及脱氮过程、NPs对耐冷菌脱氮过程的毒害作用及相应的解毒措施,并对未来可能的研究方向提出展望。
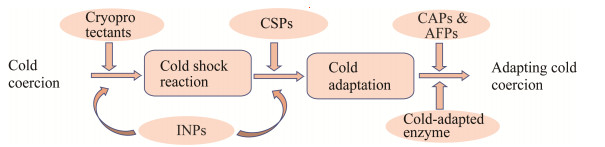
1 耐冷菌适应低温的机制与转化无机氮的途径 1.1 耐冷菌的冷适应机制低温环境在地球的某些地区持续存在,微生物在适应低温环境过程中形成了特异的冷适应机制[22],微生物抵御冷胁迫过程如图 1所示。在分离获得的耐低温微生物中,细菌占主体地位,且革兰氏阴性菌居多,其中假单胞菌属最具代表性[21]。为克服低温胁迫,耐冷微生物在细胞和分子水平上均表现出适应性反应,如细胞膜上的磷酸化和去磷酸化修饰,使溶质在低温下能顺利运输,形成对冷胁迫的快速适应[23]。此外,微生物还可通过合成冷冻保护剂、冰核蛋白(ice nucleoproteins, Inps)、防冻蛋白(antifreeze proteins, Afps)、冷休克蛋白(cold shock proteins, Csps)、冷驯化蛋白(cold acclimated proteins, Caps)和冷适应酶以适应低温环境,这些耐冷机制有利于耐冷菌长期生活在寒冷环境中,并保持正常的生长繁殖能力[24-25]。微生物产生可作为冷冻保护剂的小分子是抵御低温胁迫的第一道防线,常见的冷冻保护剂如酒精、糖和胺[26-27]。分泌的冷冻保护剂可通过共价结合提高内部溶质浓度和减少冷冻过程中靶酶与水分子之间的关联来抵御低温胁迫[28]。Inps是一种糖脂蛋白,通过在接近熔点的温度下诱导冰的结晶来防止水的快速冷却来保护微生物,此外,Inps的合成基因与Csps的合成基因均能防止mRNA形成二级结构,使mRNA能够在低温下有效地翻译,进而使微生物生长代谢活动正常进行[26]。Afps通过吸附在冰的表面降低结冰温度以抑制外部冰的生成,从而保证微生物正常生存。自第一个编码具有防冻性和冰成核活性的蛋白质基因afpA被分离和表征后,对于Afps的研究逐渐深入[28]。不同的Afps间均存在疏水性冰结合表面,这也是常见的Afps标识符[29-30]。Inps与Afps合称冰晶控制蛋白,冰晶的形成分为冰成核和冰生长两个阶段,Inps诱导胚胎冰晶的形成,而Afps通过抑制冰晶的生长来最大限度地减少冷冻损伤[31-32]。Csps有利于对冷胁迫做出快速反应,其功能是抵消应激反应的有害影响,Csps基因具有较长的5'UTR,研究证明5'UTR可以容纳一个大小为11 bp高度保守序列,即UGACGUACAGA,称为冷盒,由于较长5'UTR的存在,其他基因允许Csps合成基因在低温下维持其mRNA稳定性,从而保留如DNA复制、转录、翻译等细胞功能,确保细胞的存活和生长[33-34]。冷诱导蛋白(Csps和Caps)在细胞抵御低温胁迫过程中发挥重要作用[35]。当耐冷微生物在短期冷胁迫下会发生冷休克反应,Csps会超量表达,当耐冷微生物长期处于低温环境时,Caps则会超表达,使微生物在低温环境下长期生存。通常情况下,酶只有在特定的温度范围内才会发生作用,高温会引起酶结构的改变而导致永久性失活,低温则会抑制酶的活性,但研究发现一些冷适应酶,如节杆菌(Arthrobacter sp.)的β-半乳糖苷酶,在低温条件下能催化β-d-半乳糖苷的水解和转糖基化反应,又如菌株Burkholder pyrrocinia JK-SH007的内切1, 4-β-葡聚糖酶,在低温下酶活性增强[35-36]。
|
| 图 1 微生物抵御冷胁迫过程 Figure 1 The process of microorganisms adaption to cold coercion. INPs: Ice nucleoproteins; CSPs: Cold shock proteins; CAPs: Cold acclimated proteins; AFPs: Antifreeze proteins. |
在低温胁迫下,能量产生和应激相关的蛋白质丰度显著增加,而与生物合成和能量消耗过程相关的蛋白质减少[37],且大多数下调蛋白与细胞分裂有关[38]。耐冷微生物为在低温环境下维持正常的生理活性,在胞内或胞外积累如Inps、Afps、Csps等防冻代谢物,以维持细胞的稳定状态。此外,研究发现不同温度下生存的耐低温细菌中,其脂肪酸浓度的平均百分比也有所不同,如多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)浓度随着温度升高而降低,而单不饱和脂肪酸(monounsaturated fatty acids, MUFAs)的浓度随着温度升高而增加[39],因此PUFAs在较冷的温度下可调节细胞的生物膜流动性,提高微生物在低温环境下的生存能力[40]。然而,在抵御冷胁迫的同时,部分微生物还会产生一些具有细胞毒性的物质,如活性氧(active oxygen species, ROS)[41],因此对微生物耐冷机制进行相关研究时,还需要考虑到产生的细胞毒性物质对微生物生长与代谢的影响。
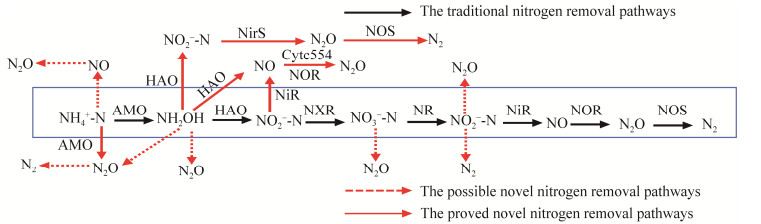
1.2 耐冷脱氮菌的脱氮过程 1.2.1 耐冷脱氮菌去除铵态氮和羟胺的反应过程目前分离得到的耐冷脱氮菌主要有硝化细菌(nitrobacteria, NOB)、反硝化细菌(denitrifying bacteria, DNB)和同时硝化反硝化(simultaneous nitrification and denitrification, SND)细菌,耐冷脱氮菌种类的不断丰富也形成了此类菌脱氮途径的多样性,如图 2所示。硝化作用是指将NH4+-N逐步转化为NO3−-N的过程,传统的好氧硝化过程为NH4+-N→ NH2OH → NO2−-N→ NO3−-N,如菌株Microbacterium sp. SFA13则是以此途径进行硝化反应[10, 42]。传统的硝化反应的第一步是转化NH4+-N,部分耐冷菌转化NH4+-N与传统转化方式不同,如Acinetobacter sp. HA2是通过短程硝化转化NH4+-N,其转化途径为NH4+-N→NH2OH→ NO2−-N→N2O→N2,此过程不产生NO3−-N,直接由NO2−-N进入反硝化过程,中间过程减少,加快了脱氮速率,分别由氨单加氧酶(ammonia monooxygenase, Amo)和羟胺氧化还原酶(hydroxylamine oxidoreductase, Hao)催化进行[43]。又如耐冷菌Pseudomonas putida Y-9的NH4+-N代谢过程为NH4+-N→NO→N2O,这是一种新的NH4+-N转化途径,其转化过程受到NO2−-N的显著抑制[44],但其终产物为N2O,该气体的温室效应比CO2强约300倍,会对环境造成严重的污染[45]。菌株Y-9在硝化过程中未检测到NH2OH、NO2−-N和NO3−-N积累,终产物为N2O,可能是由于硝化反应相关酶在该菌株中没有活性所致,而在后续的研究中发现该菌株不存在与Amo相关的基因,且Hao活性极低,因此,NH4+-N如何通过菌株Y-9高效转化为NO,进而氧化成N2O气体释放到大气中的机理还不清楚[11]。除上述2种NH4+-N转化途径外,本研究团队成员He等[45]通过对Pseudomonas taiwanensis J488的脱氮机制研究中首次发现,菌株J488可将NH4+-N直接转化为N2O,进一步转化为N2释放到大气中,即NH4+-N→N2O→N2,在NH4+-N转化过程中未检测到NH2OH、NO3−-N和NO2−-N的积累;由于菌株J488能高效转化NH2OH并产生NO2−-N,由此推测NH4+-N→ NH2OH→NO2−-N→N2O的转化途径也存在于该菌中,该菌的主要脱氮产物为N2,产生的N2O含量较少,对环境污染小。随后,本研究团队成员Chen等[13]通过检测耐冷菌Glutamicibacter arylations EM-H8脱氮过程中新形成的无机氮与相关酶活发现,菌株EM-H8转化NH2OH的途径可能为:①NH2OH→NO3−-N→气态氮,②NH2OH→NO2−-N→气态氮,③NH2OH→NO2−-N→NO3−-N和④NH2OH→有机氮,其具体终产物气体种类有待后续研究证明。
|
| 图 2 耐冷菌无机氮转化途径 Figure 2 Inorganic nitrogen transformation pathway of cold-adapted bacteria. |
1.2.2 耐冷脱氮菌去除硝态氮与亚硝态氮的反应过程
反硝化是指NO3−-N或NO2−-N逐步转化为气态氮的过程,反硝化分为厌氧反硝化和好氧反硝化。传统观点认为反硝化过程必须在厌氧或缺氧环境下才能进行,自1988年好氧反硝化细菌被发现后,反硝化必须在厌氧条件下进行这一传统观点逐渐发生改变[46]。好氧反硝化过程由硝酸盐还原酶(nitrate reductase, Nar)、亚硝酸盐还原酶(nitrite reductase, Nir)、一氧化氮还原酶(nitric oxide reductase, Nor)、氧化亚氮还原酶(nitrous oxide reductase, Nos)参与下将NO3−-N或NO2−-N最终转化为N2[47-48]。耐冷好氧反硝化细菌在低温环境条件下具有生长繁殖快、耐溶解氧、耐贫营养等优点,且部分耐冷菌反硝化过程中没有或较少的NO2−-N积累,如蔡茜等[49]报道的耐冷菌Pseudomonas monteilii H97在15 ℃条件下,可去除97.69%的NO3−-N (初始浓度为50.0 mg/L),与之相比,在温度低于20 ℃时,非耐冷菌Pseudomonas stutzeri F1的生长与反硝化脱氮作用均受到抑制,其OD600低于0.2 (30 ℃时OD600约为0.5),NO3−-N浓度从20.0 mg/L逐渐累积至140.0 mg/L;菌株Pseudomonas sp. 2–8在温度低于20 ℃时,对NO2−-N去除能力基本消失[50-51],表明耐冷菌对低温环境的适应性显著优于嗜温菌。Zheng等[51]研究发现,耐冷好氧反硝化细菌Psychrobacter sp. S1-1在高浓度NO3−-N (140.86 mg/L)或NO2-N (60.0 mg/L)条件下生长良好,且去除率分别达100%和63.50%,TN去除率分别为46.48%和31.89%,且在NO3−-N去除过程中NO2−-N积累量极少。又如王兆阳等[52]从垃圾滤液活性污泥中分离得到耐冷好氧反硝化细菌Pseudomonas sp. GL19在NO3−-N浓度为140.0 mg/L条件下,其去除效率高达100%,TN平均去除率为96.5%,无NO2−-N积累,证明了耐冷菌在低温条件下能通过反硝化进行高效脱氮。此外,同化作用也是耐冷菌去除NO2−-N的主要作用机制,在好氧反硝化过程中,耐冷菌通过同化作用将NO2−-N转换为自身生长代谢所需物质,如氨基酸,以促进自身生长[46],若能在低温条件下将无机氮同化为生物质氮,收集并加以合理利用,不仅减轻了环境污染,还使得氮素的转化或循环利用更有利于人类的发展。上述研究表明,耐冷好氧反硝化细菌在低温下的高效除氮能力使其在污水的生物修复方面具有潜在的应用前景。
1.2.3 耐冷脱氮菌同时硝化反硝化除氮的过程同时硝化反硝化(SND)细菌是指能在同一个反应器内既能进行硝化反应,又能进行好氧反硝化反应的一类细菌,该类菌摆脱了传统生物脱氮在不同阶段需氧差异的限制。自Robertson等[53]发现好氧SND细菌Thiosphaera pantotropha以来,研究者们对此类菌研究逐渐深入。本研究团队发现,SND菌株Pseudomonas taiwanensis EN-F2在25 ℃条件下具有较强的异养硝化与好氧反硝化能力,能去除100%的NH4+-N (52.90 mg/L)、100%的NH2OH (23.32 mg/L)、86.99%的NO2−-N (56.32 mg/L)和89.21%的NO3−-N (56.18 mg/L),最大去除速率分别达到了8.72、2.12、4.55和5.80 mg/(L·h),可高效去除废水中多种无机氮源[54]。对于耐冷SND细菌也有此方面报道,如Zhang等[55]分离获得一株SND菌株Pseudomonas stutzeri. YZN-001,对NH4+-N去除率为95%,去除速率为0.3 mg/L/h;在15 ℃条件下,菌株Arthrobacter arylations Y-10可去除65.0%的NH4+-N (初始浓度为208.43 mg/L),100%的NO3–-N (初始浓度为201.16 mg/L)[56]。相比于传统的自养硝化和厌氧反硝化细菌,利用SND微生物处理氮污水具有许多明显的优势,如:(1) 异养微生物生长更快,有利于长期保留在污水处理系统中;(2) 温度耐受性强,在较低温度下能进行生长代谢活动;(3) 硝化产物可直接被反硝化,中间产物NO3−-N和NO2−-N的积累较少[43]。然而,部分耐冷菌由于缺乏编码脱氮相关酶的基因导致其无法进行全程脱氮,可能会造成中间产物如NH2OH、NO3−-N和NO2−-N的大量累积,对水环境造成二次污染[57]。
综上所述,耐冷菌脱氮途径按其脱氮最终产物不同主要分为3类,其一是终产物为N2,如①NH4+-N→NH2OH→NO2−-N→N2O→N2,②NH4+-N→N2O→N2,③NH4+-N→NH2OH→NO2−-N→ NO→N2O→N2等[43, 45, 58];其二是终产物为N2O,如①NH4+-N→NO→N2O,②NH4+-N→ NH2OH→ NO2−-N→N2O[44-45];其三是终产物为有机物,微生物利用同化还原作用将无机氮,如NH4+-N、NH2OH和NO2−-N[13],转化为自身生长代谢所需含氮有机物,同化还原也是耐冷菌去除无机氮的主要途径之一;此外,部分耐冷脱氮菌能利用NO3−-N为氮源异化还原为NH4+-N,此部分作为理论研究对于揭示耐冷菌氮素转化极为重要,但由于应用性不高,目前研究该原理的团队及相关文献报道也较为缺乏[45, 52, 54]。耐冷菌的非传统生物脱氮方式极大地丰富了氮转化的途径,拓宽了生物脱氮实际应用中的最适温度范围,为将来低温条件下的氮污染废水处理提供了更佳的解决方案。
2 NPs对耐冷脱氮菌脱氮过程的毒害调控 2.1 NPs来源及分类NPs可通过风尘火山、森林火灾、动植物腐烂等自然渠道释放到环境中;也可从冶炼厂、铸铁厂、发电站、市政燃烧、污水、农业处理系统等工业途径释放到环境中[59]。工业生产是环境中工程NPs的主要来源。NPs的小尺寸预示着更大的迁移率和细胞穿透性[14]。NPs的表面效应、体积效应、量子尺寸和宏观量子隧道效应赋予了NPs巨大的比表面积和超强的吸附、催化及螯合能力,已在多领域广泛应用[60]。按属性,NPs可分为非金属、金属和金属氧化物(metal and metal oxide, MMO) NPs[61-62],其中,金属NPs按大小和组成可分为单金属NPs以及由两种或两种以上金属NPs合成的合金NPs,其中,合金NPs因协同作用在成像、诊断、治疗等方面的应用效果较好[63]。纳米技术的进步无疑为环境修复和监测带来了便利,且表现出极高的修复效率,如水处理实践中广泛使用的纳米纤维膜由于其大的表面积、极多孔的结构、适宜的孔径分布等优点在污水处理方面具有广阔前景,能高效、安全和清洁地修复污水环境,但溶解的无机物、有机化合物、悬浮物易吸附在膜表面,堵塞膜孔,限制水通量,造成膜污染,降低了废水处理的效率,膜污染也成为当前纳米纤维膜投入实际应用和工业用途的主要阻碍之一[15]。此外,研究发现,大多数NPs具有抗菌活性从而对生物产生毒害作用,当NPs通过淋浴、洗衣、清洁和雨水从消费品中释放到废水处理厂(WWTPs)及自然水生环境时,对环境和人类健康均会造成巨大危害[64]。研究证明,当人体摄入Cu NPs超过一定限度时,会导致呼吸系统异常、胃肠道损坏和皮肤病,过量摄入Cu NPs会引起黄疸,而后溶血并最终导致死亡[65]。Ag NPs会诱导肝脏特异性炎症反应,也会对细菌、鱼类、藻类产生不同程度的危害[66-67]。WWTPs是氮污染废水处理必然途径,但废水中存在的多种NPs会抑制该处理过程所涉及到的硝化细菌、反硝化细菌或异养硝化–好氧反硝化细菌的代谢功能,极大地削减了脱氮菌的氮转化效率[68]。
2.2 NPs对耐冷脱氮菌脱氮过程的影响 2.2.1 NPs对耐冷脱氮菌硝化过程的影响大量研究表明,NPs对生物脱氮过程的影响具有差异性,主要体现在细菌种类及NPs的种类、浓度、作用时间等不同条件下的氮去除效率的不同,如表 1所示。仅有少数的NPs在低浓度条件下对细菌硝化过程起促进作用或作用不显著,大多数NPs可抑制微生物的硝化过程。如0.1 mg/L的CuO NPs和NiO NPs均能显著促进耐冷菌Pseudomonas putida Y-9的生长和NH4+-N去除效率,去除率分别提高了约18.0%和5.3%,该研究结果还表明:低剂量的CuO NPs和NiO NPs可通过诱导相关酶合成和激发电子转移来提高菌株Y-9的生物活性,从而刺激菌株Y-9的NH4+-N去除反应[21];Yang等[69]报道的异养硝化细菌P. putida NP5在NiO NPs作用浓度高达100.0 mg/L时,NH4+-N的去除率仍高于90%,证明菌株NP5对NiO NPs具有较强耐受性;Hou等[70]也曾报道,50.0 mg/L CuO NPs短期暴露(8 h)于测序间歇生物膜反应器(sequencing batch biofilm reactor, SBBR)中,反应器TN去除效率为75.92%,与对照组相当(76.35%),且NH4+-N、NO2−-N和NO3−-N去除效率几乎与对照组相同,对硝化过程没有明显抑制作用。以上研究结果表明,不同硝化细菌对CuO NPs和NiO NPs的耐受性具有差异性。NPs对氮转化的影响也与NPs的种类有关,如刘美婷等[71]研究发现,在好氧条件下50.0 mg/L的CeO2 NPs和ZnO NPs降低了Nitrosomonas europaea的氨氧化效率,但2种NPs抑制率具有差异性,分别降低了(33.3±6.1)%和(60.0±9.4)%。不同的NPs对耐冷菌Y-9氮去除效率也具差异性,在相同浓度下(0.5 mg/L),CuO NPs可以促进该菌NH4+-N的氧化,而NiO NPs则抑制其生长和NH4+-N的去除效率,表明菌株Pseudomonas putida Y-9对NiO NPs更敏感[21]。NPs的暴露浓度是影响硝化作用的关键因素,NPs是否抑制氮转化过程与其浓度阈值密切相关,当CuO NPs浓度从0 mg/L增加到20.0 mg/L时,耐冷菌Pseudomonas tolaasii Y-11的NH4+-N去除效率从29.83%下降到2.33%[72]。又如Wu等[73]综合研究Zn NPs、ZnO NPs和Zn2+的对硝化菌群的影响得知,随着Zn NPs、ZnO NPs和Zn2+浓度从10.0 mg/L增加到50.0 mg/L,NH4+-N去除率分别下降到65%–80%和15%–40% (对照组NH4+-N去除率约为100%),且浓度均为0.1 mg/L时,Zn NPs和ZnO NPs均抑制了细菌的硝化作用,但Zn2+起促进作用;当浓度高于10.0 mg/L时,起抑制作用的主要物质为Zn2+,表明随着NPs暴露剂量的增加,金属离子毒害作用越强,不同浓度NPs作用下对细胞产生毒害作用的主要物质也不同。此外,NPs浓度的增加使得废水中溶解的金属离子被NPs吸附,形成较高浓度的二价阳离子废水,最终导致金属氧化物NPs在水环境中积累更多,从而产生生态毒性[72],但过高浓度NPs会带来聚集效应,降低NPs对耐冷菌脱氮过程的抑制作用。对于复杂的环境系统,如活性污泥,暴露时间长短是影响氮转化的因素之一。据报道,在(20±2) ℃条件下,Cu NPs(10.0 mg/L)暴露于反应器中1 d后,NH4+-N去除率从90.1%下降到64.8%,随着暴露时间的延长,硝化效率逐渐恢复,反应16 d后硝化作用均处于正常的水平[74]。NPs还可通过控制生物反应器活性污泥中硝化细菌的Amo表达量来影响NH4+-N的去除,然而,耐冷菌P. putida Y-9中不存在Amo,因此,NPs对耐冷菌硝化过程的抑制作用可能涉及其他目前尚未明确的作用机制[21]。
| Strain | NPs types | Reaction processes | Effective inhibition concentration | References |
| P. putida Y-9 | NiO | Nitrification | > 0.1 mg/L | [21] |
| P. putida Y-9 | CuO | Nitrification | > 0.5 mg/L | [21] |
| P. tolaasii Y-11 | CuO | Nitrification | > 0.0 mg/L | [72] |
| Microbial community | Cu | Nitrification | > 10.0 mg/L | [74] |
| Microbial community | Zn | Nitrification | 10.0 mg/L | [73] |
| Microbial community | ZnO | Nitrification | 10.0 mg/L | [73] |
| P. putida Y-9 | ZnO | Nitrification | > 0.0 mg/L | [21] |
| P. putida Y-9 | TiO2 | Nitrification | > 0.0 mg/L | [21] |
| Microbial community | CuO | Denitrification | 50.0 mg/L | [70] |
| P. tolaasii Y-11 | CuO | Denitrification | > 1.0 mg/L | [72] |
| Microbial community | Cu | Denitrification | > 10.0 mg/L | [74] |
| Microbial community | SiO2 | Denitrification | 50.0 mg/L | [76] |
| P.tolaasii Y-11 | ZnO | Denitrification | 10.0 mg/L | [81] |
2.2.2 NPs对耐冷脱氮菌反硝化过程的影响
NPs可抑制反硝化过程中关键酶的催化活性和相关基因的表达,如还原酶Nar、Nir、Nor和Nos,最终导致NO3−-N还原速率降低和NO2−-N积累量增加。研究者们普遍认为,静电力引起NPs沉积在反硝化细菌表面和ROS的产生是NPs对细胞产生毒害作用的主要原因,ROS的产生会损伤反硝化细菌的细胞壁、破坏细胞膜、损伤蛋白质和中断电子传递,进而对反硝化过程产生抑制作用[59, 75]。Hou等[70]研究发现长期(45 d)暴露于50.0 mg/L CuO NPs的间歇生物膜反应器(SBBR)中,菌群的Nar和Nir的活性明显降低,NO3−-N、NO2−-N去除效率降低,TN去除率从75.43%显著降至47.75%。非金属SiO2 NPs由于其高颗粒分散性、易于合成的优点,常与其他NPs结合成复合材料增加吸附能力,是废水处理中最受欢迎的纳米材料之一,但其在水环境中的大量积累同样对微生物产生毒害作用;为确定SiO2 NPs对反硝化的影响,有研究通过分别添加1.0 mg/L和50.0 mg/L的SiO2 NPs至反应器中,进行短期和长期暴露影响实验发现,随着1.0 mg/L SiO2 NPs暴露时间从1–70 d,NO2−-N无明显变化,当长期暴露于50.0 mg/L SiO2 NPs时,NO3−-N的浓度从(4.8±0.6) mg/L (1 d)增加到(12.1±1.1) mg/L (70 d),这些结果表明,当高浓度的SiO2 NPs (如50.0 mg/L)存在时,长期暴露后对耐冷菌高效处理氮污染废水具负面影响,这也是由于高浓度SiO2 NPs导致反硝化酶Nar和Nir活性下降所致[76]。关于NPs的毒性是由NPs本身还是释放的金属离子引起的并没有研究清楚,一般认为金属NPs可以释放金属离子到水介质中,释放的金属离子形成的离子污染物与金属NPs形成的稳定胶体分散系统相结合,导致水体的双重污染,严重影响微生物的脱氮过程。因此,研究金属和金属氧化物NPs对应金属离子对脱氮过程的影响对于揭示其抑制作用机制具有重要意义[75, 77]。He等[78]研究发现,耐冷菌Pseudomonas taiwanensis J488存在反硝化关键酶基因nirB,该菌的脱氮过程易受到金属离子的影响,低浓度的金属离子,如Ca2+ (0.5 mg/L)、Mn2+ (20.0 mg/L)、Zn2+ (5.0 mg/L)可通过刺激Nir、Nos、Nor等反硝化相关酶的基因的表达来促进NO3−-N向N2转化,使NO3−-N去除效率分别提高了1.33%、3.33%、5.99%和1.53%;而高浓度(30.0 mg/L)的金属离子Ca2+、Mn2+及Zn2+处理时,其反硝化过程均受到了抑制作用。尽管如此,菌株J488在30.0 mg/L的Zn2+作用下仍能进行反硝化作用,对TN的去除稳定不变,表明该菌具有较高的金属离子耐受性。相关研究表明,耐冷菌反硝化作用相关酶比硝化作用相关酶对NPs耐受性更高[72, 79],其可能原因是许多反硝化过程的还原酶含有某些金属离子,如Cu2+和Zn2+均为Nos、Nor、Nir等还原酶的组成成分。另外,有研究发现多金属系统的协同抑制可能低于单个金属的抑制作用[80],故本身存在金属离子的还原酶可能需要NPs释放出来的金属离子,又或溶液中共存的离子间相互作用降低了单一NPs的毒性,进而增加了细菌对NPs的耐受性。总之,NPs对整个脱氮过程的影响表现出低剂量促进和高剂量抑制的效果[78]。
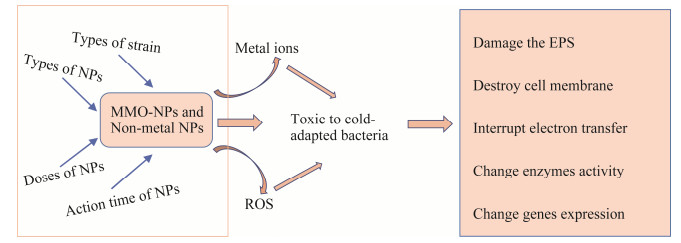
2.3 NPs对耐冷脱氮菌的毒害作用机制NPs毒性取决于其大小、形状、暴露持续时间、浓度及在胞内产生的氧自由基和氧化应激[82],如图 3所示。NPs对耐冷菌的毒害作用通常从以下几个方面进行评估:功能退化、细胞损伤、参与脱氮过程的酶活性下降、功能基因表达的下调和微生物群落结构的变化[64]。其毒性机制如下:(1) NPs溶解的金属离子与细菌细胞壁中带负电荷的化合物结合,导致细胞壁不稳定或塌陷;NPs溶解释放的金属离子对含有–SH基团的蛋白质具有高亲和能力,这种结合可以破坏维持蛋白质完整性所必需的S–S键,而后直接破坏某些酶的功能[72, 83]。(2) 产生ROS导致细胞毒害作用。金属NPs的溶解也会产生ROS,ROS通过氧化膜组分(如脂质)导致细胞膜损伤,使酶失活或抑制外多糖的形成,内化的金属离子也可以与胞内物质反应并产生胞内ROS,胞内产生的ROS也可通过脂质氧化损害细胞膜或DNA/RNA[70, 72, 75];部分非金属NPs,如TiO2 NPs,具光催化活性,其能量高于能隙带能量或其能级引发光激发现象时从而促进ROS的产生,造成氧化胁迫,损伤细胞,ROS的增加会导致酶失活和DNA损伤,这可能是与硝化有关的关键酶被抑制的原因[84],此外,NPs本身可进入细胞并与细胞内DNA、蛋白质及其他生物分子结合,诱导ROS产生或损害细胞功能[73]。(3) NPs和胞外聚合物质(extracellular polymers, EPS)之间的强相互作用可能导致微生物剥离具保护作用的EPS层,使微生物更容易受到伤害[64, 70]。(4) 中断电子传递。NPs可使微生物的电子转移中断,产生静电效应,降低耐冷菌的活性,进而降低金属蛋白酶或脱氮功能酶的表达量,使氮素的利用和转化率降低[21, 72];如Yang等[81]采用傅立叶红外光谱分析(FTIR)发现ZnO NPs作用下,光谱在642 cm−1处出现峰值,经分析对应ZnO NPs的拉伸振动,证明了ZnO NPs使得耐冷菌P. tolaasii Y-11的官能团发生改变,即该菌原本的电子转移发生改变。(5) NPs毒害作用对硝化与反硝化过程相关基因的调控。NPs毒害作用使暴露于NPs的细菌基因组表达量发生变化,研究证明,在50.0 mg/L Zn NPs作用下,可导致硝化菌群amoA基因表达下调及hao、nxrA基因表达上调[73]。
2.4 减缓NPs对耐冷脱氮菌产生毒害作用的相关措施
减少NPs对耐冷脱氮菌毒害作用的相关措施大致可分为两类,其一从NPs本身出发,提高NPs的稳定性或降低其溶解释放出来的金属离子浓度来减轻NPs对微生物的毒害程度;其二从微生物自身出发,即加强微生物对NPs的屏障和抵抗作用。具体措施如下:(1) 添加有机物三氯生(TCS)可以减轻NPs对耐冷脱氮菌造成的损害[79]。有机物可以改变NPs的聚集、暂停和运输,三氯生(triclosan, TCS)的存在增加了环境中的有机物,使得Cu NPs的团聚程度有所增加,降低了NPs对硝化菌的毒害作用,但TCS会污染环境,该物质的存在会导致污泥结构变得松散,使其沉降性能变差[74, 85]。(2) 添加牛血清白蛋白(bovine serum albumin, BSA)。BSA为天然有机质(natural organic matter, NOM),易吸附在CuO NPs表面官能团上,尤其是酰胺和羧基,导致静电斥力增加,增强NPs聚集,增加了CuO NPs团聚体的尺寸,阻碍了NPs与生物膜上的负电荷和官能团的直接接触,以此缓解NPs对耐冷菌的毒害作用[70]。(3) 添加抗生素。Zhang等[86]研究表明,抗生素或NPs单独作用于反硝化细菌时均导致反硝化关键基因nosZ的表达量降低,同时可降低菌群的相对丰度,以此抑制NO3−-N的去除,而当二者混合时,抗生素的存在使得NPs吸附在其表面,进而减少了二者与脱氮菌直接接触的概率,进而降低NPs的毒害作用,促进氮转化效率。(4) 加入外源性Fe2+。外源性Fe2+可增强NPs的静电斥力,促进Fe2+吸附在NPs的表面,进而在NPs的表面上形成“涂层”,有效阻碍NPs与细胞膜之间的物理接触,此外,外源性Fe2+的加入还可促进ZnO和CuO NPs的胞外聚集,减缓NPs扩散,进一步抑制NPs释放有毒离子,增强细菌对NPs的抗性。如外源性Fe2+的添加减缓了CuO和ZnO NPs对菌株Pseudomonas tolaasii Y-11的毒害作用,其原因可能是Fe2+是该菌株金属蛋白酶或某些功能酶的辅酶因子,可促进电子转移,提高酶的活性,从而提高菌株Y-11对氮的利用和转化能力,添加的Fe2+对环境不造成二次污染,减少了污水处理的负担,是减缓NPs对耐冷脱氮菌毒害作用的理想措施[72, 81]。(5) 通过控制细胞外聚合物质(extracellular polymeric substances, EPS)的产生来保护微生物免受NPs的危害。EPS主要分为两类,松散结合EPS (loosely bound EPS, LB-EPS)和紧密结合EPS (tightly bound EPS, TB-EPS),具有特定形状的TB-EPS存在于生物膜的内层,而LB-EPS在外层[87]。LB-EPS松散多孔结构为NPs的吸附提供了足够的吸附位点,TB-EPS的紧密结构为细菌内部免受毒害作用提供了保护。EPS作为微生物抵御NPs毒害作用的第一道防线,起着至关重要的作用,因NPs的带电表面易与EPS上的离子官能团(例如羟基、羧基、胺基等)之间结合,可吸附NPs,使NPs团聚体直径大于生物膜孔径(生物膜孔径为10–50 nm),阻碍NPs进入细菌体内[88]。多糖(polysaccharides, PS)、蛋白质(proteins, PRO)和腐植酸(humic acids, HA)是EPS的主要成分,PS可以增大CeO2 NPs的流体动力学直径,使NPs几乎无法进入细胞;死细胞被分解会产生PRO和HA,而PRO和HA浓度的提高会促进活细胞吸收更多的营养物质,促进EPS的形成,因此可通过离心、超声破碎和热提取方法分馏得到死细胞EPS的主要成分(如PS和PRO)并加入至存活的菌群中,促进菌群分泌更多的EPS来抵御NPs的毒害作用[70, 89-90]。Khan等[91]通过化学实验发现离子、非离子表面活性剂十二烷基硫酸钠(sodium lauryl sulfate, SLS)和壬基酚聚氧乙烯醚(nonylphenol ethoxylate, Tergitol NP-9)可促进合成废水中CuO NPs的聚集和沉降,且SLS对CuO NPs的聚集性比NP-9更佳,表面活性剂通过增强NPs在天然水中的胶体稳定性,从而影响NPs在水处理过程中的迁移和去除,但该方法针对耐冷脱氮菌的影响效果目前缺乏研究证明。此外,已有研究团队利用硫化物(如抗氧化剂谷胱甘肽)和金属离子螯合剂(如PBS缓冲液)以降低相关NPs对细胞的毒害作用,还原谷胱甘肽(glutathione, GSH),是一种三肽硫醇,在氧化GSH的过程中可清除NPs产生的ROS分子,进而保护细胞免受有害氧化还原反应的损伤,而PBS缓冲液会使ZnO NPs在该溶液中形成络合物而沉淀,因而降低ZnO NPs溶解的Zn2+浓度,从而降低NPs对大肠杆菌的毒害作用;但目前利用硫化物和金属离子螯合剂减缓NPs对耐冷脱氮菌毒害作用的相关报道较为缺乏,后续可设计合理实验方案进行探究[45, 92]。综上所述,目前减轻NPs对耐冷脱氮菌或其他微生物的危害作用的措施大部分是添加有机物或氮转化过程关键酶的辅酶因子(如金属离子),有机物通过增大NPs团聚体直径,使其聚集后沉淀,金属离子则是作用于微生物自身,提高微生物抵御NPs毒害的能力,但很多有机物及金属离子本身对生物体具有潜在的危害作用,其在废水处理系统中的回收利用率是否达到标准,也将给污水治理带来新的挑战,给人类健康造成未知的威胁,因此在探究减缓NPs对耐冷脱氮菌毒害作用的措施时,应充分评估外加物质对环境和生物体带来的危害。
3 结论与展望耐冷脱氮菌由于其特殊的耐冷机制,为低温下废水处理提供了新的媒介,其存在如NH4+-N→ NO→N2O和NH4+-N→N2O→N2的非传统的氮转化途径,丰富了氮循环过程。NPs对氮转化过程的抑制作用受到多种条件的影响,总体表现为低浓度促进,高浓度抑制。NPs在氮污染废水中主要通过影响硝化和反硝化过程相关酶的活性和基因表达来降低微生物的氮转化能力,且硝化相关酶对NPs的敏感度高于反硝化相关酶。离子组成、离子强度、有机物等介质的化学性质会影响NPs的聚集、表面电荷和化学形式,也成为研究减缓NPs毒害作用措施的突破口。文章总结了耐冷菌的适冷机制及脱氮过程,阐述NPs对耐冷菌脱氮过程的影响,分析了NPs对耐冷菌的毒害机制及NPs胁迫下的解毒措施。然而,当前针对NPs对耐冷菌脱氮过程影响的相关研究主要聚焦于CuO NPs、ZnO NPs、NiO NPs等几种常见NPs,且研究过程多在单一NPs作用下进行,与实际水环境中多种NPs共同存在的情况具有差异。对NPs的解毒机制也主要集中在单一NPs作用下进行,因此,今后的研究方向可从以下几个方面展开:
(1) 在耐冷菌中新发现的脱氮途径中,能直接将NH4+-N转化为N2,且中间有害产物,如NH2OH和NO2–-N的积累量较少,具有理想的脱氮效果,但其具体转化过程尚未阐明,因此可深入研究其脱氮机理,为低温条件下的氮废水处理工艺提供新的视角和策略。
(2) 目前针对NPs对耐冷菌脱氮过程影响的研究较为单一,可开展多种类与多浓度NPs存在下的作用效果探索。
(3) 探究耐冷脱氮菌在多种类与多浓度NPs胁迫下的减毒措施,包括如何增强关键酶的活性、增加相关功能基因表达量、降低ROS产生、加速NPs聚集和促进电子转移。
| [1] | SOLER-JOFRA A, PÉREZ J, van LOOSDRECHT MCM. Hydroxylamine and the nitrogen cycle: a review. Water Research, 2021, 190: 116723. DOI:10.1016/j.watres.2020.116723 |
| [2] | YANG T, YANG Q, SHI Y, XIN Y, ZHANG L, GU ZH, SHI GY. Insight into the denitrification mechanism of Bacillus subtilis JD-014 and its application potential in bioremediation of nitrogen wastewater. Process Biochemistry, 2021, 103: 78-86. DOI:10.1016/j.procbio.2021.02.007 |
| [3] | MOHSENPOUR SF, HENNIGE S, WILLOUGHBY N, ADELOYE A, GUTIERREZ T. Integrating micro-algae into wastewater treatment: a review. Science of the Total Environment, 2021, 752: 142168. DOI:10.1016/j.scitotenv.2020.142168 |
| [4] | LI YJ, JIN HY, CHEN JF, WANG DQ, YANG Z, WANG B, ZHUANG YP, WANG R. Nitrogen removal through sediment denitrification in the Yangtze Estuary and its adjacent east China Sea: a nitrate limited process during summertime. Science of the Total Environment, 2021, 795: 148616. DOI:10.1016/j.scitotenv.2021.148616 |
| [5] |
HE TX, CHEN MP, DING CY, LI Z, LIU YT, WANG J. The release mechanism of nitrous oxide during microbial nitrogen removal process and related measures to lower its emission. Biotic Resources, 2021, 43(1): 17-25.
(in Chinese) 何腾霞, 陈梦苹, 丁晨雨, 李祝, 刘玉婷, 王婧. 微生物脱氮过程中氧化亚氮的释放机理及减释措施. 生物资源, 2021, 43(1): 17-25. |
| [6] | MIAO L, YANG GQ, TAO T, PENG YZ. Recent advances in nitrogen removal from landfill leachate using biological treatments-a review. Journal of Environmental Management, 2019, 235: 178-185. |
| [7] |
WU S, WANG SY, WANG F, JI M. Effect of temperature on ANAMMOX process in sequencing batch biofilm reactors: nitrogen removal performance and bacterial community. Environmental Science, 2022, 43(1): 416-423.
(in Chinese) 吴珊, 王淑雅, 王芬, 季民. 温度对ANAMMOX生物膜工艺的脱氮影响与菌群结构分析. 环境科学, 2022, 43(1): 416-423. DOI:10.13227/j.hjkx.202105280 |
| [8] | XU ZZ, BEN Y, CHEN ZL, JIANG AX, SHEN JM, HAN XY. Application and microbial ecology of psychrotrophs in domestic wastewater treatment at low temperature. Chemosphere, 2018, 191: 946-953. DOI:10.1016/j.chemosphere.2017.10.121 |
| [9] |
BEN Y, CHEN ZL, XU ZZ, QI F, YE MM, SHEN JM, JIANG AX. Selection and kinetic mechanism of psychrotrophs in low temperature wastewater treatment. Environmental Science, 2008, 29(11): 3189-3193.
(in Chinese) 贲岳, 陈忠林, 徐贞贞, 齐飞, 叶苗苗, 沈吉敏, 姜安玺. 低温生活污水处理系统中耐冷菌的筛选及动力学研究. 环境科学, 2008, 29(11): 3189-3193. DOI:10.3321/j.issn:0250-3301.2008.11.035 |
| [10] |
WANG SJ, WANG X, LU GL, WANG QH, LI FS, GUO GL. Bioremediation of petroleum hydrocarbon-contaminated soils by cold-adapted microorganisms: research advance. Chinese Journal of Applied Ecology, 2011, 22(4): 1082-1088.
(in Chinese) 王世杰, 王翔, 卢桂兰, 汪群慧, 李发生, 郭观林. 低温微生物修复石油烃类污染土壤研究进展. 应用生态学报, 2011, 22(4): 1082-1088. DOI:10.13287/j.1001-9332.2011.0112 |
| [11] | HUANG XJ, XU Y, HE TX, JIA HJ, FENG M, XIANG SD, WANG ST, NI JP, XIE DT, LI ZL. Ammonium transformed into nitrous oxide via nitric oxide by Pseudomonas putida Y-9 under aerobic conditions without hydroxylamine as intermediate. Bioresource Technology, 2019, 277: 87-93. DOI:10.1016/j.biortech.2019.01.040 |
| [12] | HE TX, YE Q, SUN Q, CAI X, NI JP, LI ZL, XIE DT. Removal of nitrate in simulated water at low temperature by a novel psychrotrophic and aerobic bacterium, Pseudomonas taiwanensis strain J. BioMed Research International, 2018, 2018: 4984087. |
| [13] | CHEN MP, DING CY, HE TX, ZHANG MM, WU QF. Efficient hydroxylamine removal through heterotrophic nitrification by novel bacterium Glutamicibacter arilaitensis EM-H8. Chemosphere, 2022, 288: 132475. DOI:10.1016/j.chemosphere.2021.132475 |
| [14] | CUONG HN, PANSAMBAL S, GHOTEKAR S, OZA R, THANH HAI NT, VIET NM, NGUYEN VH. New frontiers in the plant extract mediated biosynthesis of copper oxide (CuO) nanoparticles and their potential applications: a review. Environmental Research, 2022, 203: 111858. DOI:10.1016/j.envres.2021.111858 |
| [15] | EL-ASWAR EI, RAMADAN H, ELKIK H, TAHA AG. A comprehensive review on preparation, functionalization and recent applications of nanofiber membranes in wastewater treatment. Journal of Environmental Management, 2022, 301: 113908. DOI:10.1016/j.jenvman.2021.113908 |
| [16] | YANG XY, CHEN Y, GUO FC, LIU XB, SU XX, HE Q. Metagenomic analysis of the biotoxicity of titanium dioxide nanoparticles to microbial nitrogen transformation in constructed wetlands. Journal of Hazardous Materials, 2020, 384: 121376. DOI:10.1016/j.jhazmat.2019.121376 |
| [17] | LU SL, ZHANG WC, ZHANG R, LIU PW, WANG QX, SHANG Y, WU MH, DONALDSON K, WANG QY. Comparison of cellular toxicity caused by ambient ultrafine particles and engineered metal oxide nanoparticles. Particle and Fibre Toxicology, 2015, 12(1): 5. DOI:10.1186/s12989-015-0082-8 |
| [18] | FU JJ, HUANG DQ, LU ZY, MA YL, XU XW, HUANG BC, FAN NS, JIN RC. Comparison of the dynamic responses of different anammox granules to copper nanoparticle stress: antibiotic exposure history made a difference. Bioresource Technology, 2021, 333: 125186. DOI:10.1016/j.biortech.2021.125186 |
| [19] |
LI W, SHI XY. Effects of ZnO nanoparticles on nitrogen removal performance and nitrifying bacteria abundance of activated sludge in SBR. Chinese Journal of Environmental Engineering, 2017, 11(8): 4549-4558.
(in Chinese) 李维, 石先阳. 氧化锌纳米颗粒对SBR中活性污泥脱氮性能及硝化细菌丰度的影响. 环境工程学报, 2017, 11(8): 4549-4558. |
| [20] |
FAN FH, ZHENG RB, LIU S, GUO XL. Effects of TiO2 nanoparticles on the denitrification and N2O emissions of marsh soil. Acta Ecologica Sinica, 2021, 41(16): 6525-6532.
(in Chinese) 范峰华, 郑荣波, 刘爽, 郭雪莲. 二氧化钛纳米颗粒对沼泽土壤反硝化和N2O排放的影响. 生态学报, 2021, 41(16): 6525-6532. |
| [21] | HUANG XJ, WANG YX, NI JP, XIE DT, LI ZL. Metal oxide nanoparticles resonate to ammonium removal through influencing Mg2+ absorption by Pseudomonas putida Y-9. Bioresource Technology, 2020, 296: 122339. DOI:10.1016/j.biortech.2019.122339 |
| [22] | KUMAR S, SUYAL DC, YADAV A, SHOUCHE Y, GOEL R. Microbial diversity and soil physiochemical characteristic of higher altitude. PLoS One, 2019, 14(3): e0213844. DOI:10.1371/journal.pone.0213844 |
| [23] |
ZHANG YR, LI ZX, SUN Y, ZHOU SL. Research progress on nitrogen removal of cold resistance aerobic denitrifying bacteria. Environmental Engineering, 2019, 37(12): 22-28.
(in Chinese) 张艺冉, 李再兴, 孙悦, 周石磊. 耐冷好氧反硝化菌脱氮技术研究进展. 环境工程, 2019, 37(12): 22-28. |
| [24] | RAFIQ M, HAYAT M, ANESIO AM, JAMIL SUU, HASSAN N, SHAH AA, HASAN F. Recovery of metallo-tolerant and antibiotic resistant psychrophilic bacteria from Siachen glacier, Pakistan. PLoS One, 2017, 12(7): e0178180. DOI:10.1371/journal.pone.0178180 |
| [25] | SINHA N. Psychrotrophic bacteria: a boonto higher altitude agriculture. Indian Journal of Agricultural Biochemistry, 2019, 32(1): 10. DOI:10.5958/0974-4479.2019.00002.9 |
| [26] | XU H, GRIFFITH M, PATTEN CL, GLICK BR. Isolation and characterization of an antifreeze protein with ice nucleation activity from the plant growth promoting rhizobacterium Pseudomonas putida GR12-2[J]. Canadian Journal of Microbiology, 1998(1), 44: 64-73. |
| [27] | YAMAMOTO T, HASEGAWA Y, KAWAHARA H, IWAKI H. Complete genome sequence of Pseudomonas sp. strain KUIN-1, a model strain for studies on the production of cell-free ice nucleation proteins. Microbiology Resource Announcements, 2019, 8(45): e01204-e01219. |
| [28] | MURYOI N, SATO M, KANEKO S, KAWAHARA H, OBATA H, YAISH MWF, GRIFFITH M, GLICK BR. Cloning and expression of afpA, a gene encoding an antifreeze protein from the Arctic plant growth-promoting rhizobacterium Pseudomonas putida GR12-2. Journal of Bacteriology, 2004, 186(17): 5661-5671. DOI:10.1128/JB.186.17.5661-5671.2004 |
| [29] |
ZHANG WJ, SHAO XG, CAI WS. Molecular simulation of the antifreeze mechanism of antifreeze proteins. Progress in Chemistry, 2021, 33(10): 1797-1811.
(in Chinese) 张维佳, 邵学广, 蔡文生. 抗冻蛋白抗冻机制的分子模拟研究. 化学进展, 2021, 33(10): 1797-1811. |
| [30] | MIDDLETON AJ, MARSHALL CB, FAUCHER F, BAR-DOLEV M, BRASLAVSKY I, CAMPBELL RL, WALKER VK, DAVIES PL. Antifreeze protein from freeze-tolerant grass has a beta-roll fold with an irregularly structured ice-binding site. Journal of Molecular Biology, 2012, 416(5): 713-724. DOI:10.1016/j.jmb.2012.01.032 |
| [31] | LORV JSH, ROSE DR, GLICK BR. Bacterial ice crystal controlling proteins. Scientifica, 2014, 2014: 976895. |
| [32] | KOH HY, PARK H, LEE JH, HAN SJ, SOHN YC, LEE SG. Proteomic and transcriptomic investigations on cold-responsive properties of the psychrophilic Antarctic bacterium Psychrobacter sp. PAMC 21119 at subzero temperatures. Environmental Microbiology, 2017, 19(2): 628-644. DOI:10.1111/1462-2920.13578 |
| [33] | MUCHAAMBA F, STEPHAN R, TASARA T. Listeria monocytogenes cold shock proteins: small proteins with a huge impact. Microorganisms, 2021, 9(5): 1061. DOI:10.3390/microorganisms9051061 |
| [34] | CARDOZA E, SINGH H. C group-mediated antibiotic stress mimics the cold shock response. Current Microbiology, 2021, 78(9): 3372-3380. DOI:10.1007/s00284-021-02613-7 |
| [35] | RUTKIEWICZ M, WANARSKA M, BUJACZ A. Mapping the transglycosylation relevant sites of cold-adapted β-d-galactosidase from Arthrobacter sp. 32cB. International Journal of Molecular Sciences, 2020, 21(15): 5354. DOI:10.3390/ijms21155354 |
| [36] | CHEN FF, YE JR, SISTA KAMESH WAR AK, WU XL, REN JH, QIN WS, LI DW. A novel cold-adaptive endo-1, 4-β-glucanase from Burkholderia pyrrocinia JK-SH007: gene expression and characterization of the enzyme and mode of action. Frontiers in Microbiology, 2020, 10: 3137. DOI:10.3389/fmicb.2019.03137 |
| [37] | ORTIZ-OJEDA P, OGATA-GUTIÉRREZ K, ZÚÑIGA-DÁVILA D. Evaluation of plant growth promoting activity and heavy metal tolerance of psychrotrophic bacteria associated with maca (Lepidium meyenii Walp.) rhizosphere. AIMS Microbiology, 2017, 3(2): 279-292. DOI:10.3934/microbiol.2017.2.279 |
| [38] | SUYA DC, YADAV A, COUCHE Y, GOEL R. Differential proteomics in response to low temperature diazotrophy of Himalayan psychrophilic nitrogen fixing Pseudomonas. Current Microbiology, 2014, 68(4): 543-550. DOI:10.1007/s00284-013-0508-1 |
| [39] | SINGH P, TSUJI M, SINGH SM, ROY U, HOSHINO T. Taxonomic characterization, adaptation strategies and biotechnological potential of cryophilic yeasts from ice cores of Midre Lovénbreen glacier, Svalbard, Arctic. Cryobiology, 2013, 66(2): 167-175. DOI:10.1016/j.cryobiol.2013.01.002 |
| [40] | ROBINSON CH. Cold adaptation in Arctic and Antarctic fungi. New Phytologist, 2001, 151(2): 341-353. DOI:10.1046/j.1469-8137.2001.00177.x |
| [41] | TIRYAKI D, AYDIN İ, ATICI Ö. Psychrotolerant bacteria isolated from the leaf apoplast of cold-adapted wild plants improve the cold resistance of bean (Phaseolus vulgaris L.) under low temperature. Cryobiology, 2019, 86: 111-119. DOI:10.1016/j.cryobiol.2018.11.001 |
| [42] | ZHANG DY, LI WG, HUANG XF, QIN W, LIU M. Removal of ammonium in surface water at low temperature by a newly isolated Microbacterium sp. strain SFA13. Bioresource Technology, 2013, 137: 147-152. DOI:10.1016/j.biortech.2013.03.094 |
| [43] | YAO S, NI JR, MA T, LI C. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2. Bioresource Technology, 2013, 139: 80-86. DOI:10.1016/j.biortech.2013.03.189 |
| [44] |
XU Y. Study on nitrogen removal characteristics and its nitrogen metabolism mechanism of Pseudomonas putida Y-9[D]. Chongqing: Master's Thesis of Southwest University, 2018 (in Chinese). 徐义. Pseudomonas putida Y-9的脱氮特性及其氮代谢机制研究[D]. 重庆: 西南大学硕士学位论文, 2018. |
| [45] | HE TX, XIE DT, NI JP, LI Z, LI ZL. Nitrous oxide produced directly from ammonium, nitrate and nitrite during nitrification and denitrification. Journal of Hazardous Materials, 2020, 388: 122114. DOI:10.1016/j.jhazmat.2020.122114 |
| [46] |
HE TX, LI ZL, Yang S. Research progress in aerobic denitrifier and its removing mechanism of nitrite. The Chinese Journal of Process Engineering, 2015, 15(1): 174-180.
(in Chinese) 何腾霞, 李振轮, 杨珊. 好氧反硝化细菌及其去除亚硝酸盐的作用机理研究进展. 过程工程学报, 2015, 15(1): 174-180. |
| [47] | GUO LY, CHEN QK, FANG F, HU ZX, WU J, MIAO AJ, XIAO L, CHEN XF, YANG LY. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water. Bioresource Technology, 2013, 142: 45-51. DOI:10.1016/j.biortech.2013.05.021 |
| [48] | KONG DD, LI WB, DENG YL, RUAN YJ, CHEN GS, YU JH, LIN FC. Denitrification-potential evaluation and nitrate-removal-pathway analysis of aerobic denitrifier strain Marinobacter hydrocarbonoclasticus RAD-2. Water, 2018, 10(10): 1298. DOI:10.3390/w10101298 |
| [49] |
CAI X, HE TX, YE Q, LI ZL. Identification and characterization of a hypothermic alkaliphilic aerobic denitrifying bacterium Pseudomonas monteilii strain H97. Environmental Science, 2018, 39(7): 3314-3320.
(in Chinese) 蔡茜, 何腾霞, 冶青, 李振轮. 耐冷嗜碱蒙氏假单胞菌H97的鉴定及其好氧反硝化特性. 环境科学, 2018, 39(7): 3314-3320. |
| [50] |
GAO XY, LIU Y, ZHENG HY, LIU Y, LIU ZP. Identification and characteristics of a marine aerobic denitrifying bacterium. Acta Microbiologica Sinica, 2010, 50(9): 1164-1171.
(in Chinese) 高喜燕, 刘鹰, 郑海燕, 刘缨, 刘志培. 一株海洋好氧反硝化细菌的鉴定及其好氧反硝化特性. 微生物学报, 2010, 50(9): 1164-1171. |
| [51] | ZHENG HY, LIU Y, SUN GD, GAO XY, ZHANG QL, LIU ZP. Denitrification characteristics of a marine origin psychrophilic aerobic denitrifying bacterium. Journal of Environmental Sciences, 2011, 23(11): 1888-1893. DOI:10.1016/S1001-0742(10)60615-8 |
| [52] |
WANG ZY, CHEN GY, JIANG K, XU PY. Identification and denitrification characteristics of a psychrotolerant facultative basophilic aerobic denitrifier. Environmental Science, 2014, 35(6): 2341-2348.
(in Chinese) 王兆阳, 陈国耀, 姜珂, 许培雅. 1株耐冷兼性嗜碱好氧反硝化菌的分离鉴定及反硝化特性. 环境科学, 2014, 35(6): 2341-2348. |
| [53] | ROBERTSON LA, van NIEL EW, TORREMANS RA, KUENEN JG. Simultaneous nitrification and denitrification in aerobic chemostat cultures of Thiosphaera pantotropha. Applied and Environmental Microbiology, 1988, 54(11): 2812-2818. DOI:10.1128/aem.54.11.2812-2818.1988 |
| [54] | ZHANG MM, HE TX, CHEN MP, WU QF. Ammonium and hydroxylamine can be preferentially removed during simultaneous nitrification and denitrification by Pseudomonas taiwanensis EN-F2. Bioresource Technology, 2022, 350: 126912. DOI:10.1016/j.biortech.2022.126912 |
| [55] | ZHANG JB, WU PX, HAO B, YU ZN. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001. Bioresource Technology, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
| [56] |
HE TX, NI JP, LI ZL, SUN Q, YE Q, XU Y. Heterotrophic nitrification and aerobic denitrification of the hypothermia aerobic denitrification bacterium: Arthrobacter arilaitensis. Environmental Science, 2016, 37(3): 1082-1088.
(in Chinese) 何腾霞, 倪九派, 李振轮, 孙权, 冶青, 徐义. 1株Arthrobacter arilaitensis菌的耐冷异养硝化和好氧反硝化作用. 环境科学, 2016, 37(3): 1082-1088. |
| [57] | SONG T, ZHANG XL, LI J, WU XY, FENG HX, DONG WY. A review of research progress of heterotrophic nitrification and aerobic denitrification microorganisms (HNADMs). Science of the Total Environment, 2021, 801: 149319. DOI:10.1016/j.scitotenv.2021.149319 |
| [58] | HUANG XF, LI WG, ZHANG DY, QIN W. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature. Bioresource Technology, 2013, 146: 44-50. DOI:10.1016/j.biortech.2013.07.046 |
| [59] | CHIBBER S, SHANKER R. Can CuO nanoparticles lead to epigenetic regulation of antioxidant enzyme system?. Journal of Applied Toxicology: JAT, 2017, 37(1): 84-91. DOI:10.1002/jat.3392 |
| [60] |
CHENG Z, SHEN BX, LV HH, WANG XD, YANG W. Application of stabilizers in improving environmental remediation performance of nanomaterials and their composites. Environmental Engineering, 2022, 40(2): 225-234.
(in Chinese) 程姿, 沈伯雄, 吕宏虹, 王旭东, 杨伟. 稳定剂在提高纳米材料及其复合材料环境修复性能中的应用综述. 环境工程, 2022, 40(2): 225-234. |
| [61] | GAO LB, REN WC, LIU BL, WU ZS, JIANG CB, CHENG HM. Crystallographic tailoring of graphene by nonmetal SiO(x) nanoparticles. Journal of the American Chemical Society, 2009, 131(39): 13934-13936. DOI:10.1021/ja906610e |
| [62] | CHEN YG, ZHANG XY, LIU WG. Effect of metal and metal oxide engineered nano particles on nitrogen bio-conversion and its mechanism: a review. Chemosphere, 2022, 287: 132097. DOI:10.1016/j.chemosphere.2021.132097 |
| [63] | HUYNH KH, PHAM XH, KIM J, LEE SH, CHANG H, RHO WY, JUN BH. Synthesis, properties, and biological applications of metallic alloy nanoparticles. International Journal of Molecular Sciences, 2020, 21(14): 5174. DOI:10.3390/ijms21145174 |
| [64] | XING Y, HARPER WF JR. The effects of engineered nanoparticles on nitrification during biological wastewater treatment. Biotechnology and Bioengineering, 2021, 118(7): 2401-2410. DOI:10.1002/bit.27746 |
| [65] | NAZ S, GUL A, ZIA M. Toxicity of copper oxide nanoparticles: a review study. IET Nanobiotechnology, 2020, 14(1): 1-13. DOI:10.1049/iet-nbt.2019.0176 |
| [66] | KERMANIZADEH A, JACOBSEN NR, ROURSGAARD M, LOFT S, MØLLER P. Hepatic hazard assessment of silver nanoparticle exposure in healthy and chronically alcohol fed mice. Toxicological Sciences: an Official Journal of the Society of Toxicology, 2017, 158(1): 176-187. DOI:10.1093/toxsci/kfx080 |
| [67] | RIBEIRO F, GALLEGO-URREA JA, JURKSCHAT K, CROSSLEY A, HASSELLÖV M, TAYLOR C, SOARES AMVM, LOUREIRO S. Silver nanoparticles and silver nitrate induce high toxicity to Pseudokirchneriella subcapitata, Daphnia magna and Danio rerio. Science of the Total Environment, 2014, 466/467: 232-241. DOI:10.1016/j.scitotenv.2013.06.101 |
| [68] | ZHANG ZZ, XU JJ, SHI ZJ, CHENG YF, JI ZQ, DENG R, JIN RC. Short-term impacts of Cu, CuO, ZnO and Ag nanoparticles (NPs) on anammox sludge: CuNPs make a difference. Bioresource Technology, 2017, 235: 281-291. DOI:10.1016/j.biortech.2017.03.135 |
| [69] | YANG L, WANG XH, CUI S, REN YX, YU J, CHEN N, XIAO Q, GUO LK, WANG RH. Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5. Bioresource Technology, 2019, 285: 121360. |
| [70] | HOU J, YOU GX, XU Y, WANG C, WANG PF, MIAO LZ, AO YH, LI Y, LV BW, YANG YY. Impacts of CuO nanoparticles on nitrogen removal in sequencing batch biofilm reactors after short-term and long-term exposure and the functions of natural organic matter. Environmental Science and Pollution Research, 2016, 23(21): 22116-22125. |
| [71] |
LIU MT, YU R, CHEN LH, WU JK. Biological effects of typical metal oxide nanoparticles on Nitrosomonas europaea. China Environmental Science, 2015, 35(1): 190-195.
(in Chinese) 刘美婷, 余冉, 陈良辉, 吴俊康. 典型纳米金属氧化物对氨氧化菌Nitrosomonas europaea的生物胁迫影响. 中国环境科学, 2015, 35(1): 190-195. |
| [72] | YANG YR, ZHANG C, HUANG XJ, GUI XW, LUO YF, LI ZL. Exogenous Fe2+ alleviated the toxicity of CuO nanoparticles on Pseudomonas tolaasii Y-11 under different nitrogen sources. PeerJ, 2020, 8: e10351. |
| [73] | WU Q, HUANG KL, SUN HH, REN HQ, ZHANG XX, YE L. Comparison of the impacts of zinc ions and zinc nanoparticles on nitrifying microbial community. Journal of Hazardous Materials, 2018, 343: 166-175. |
| [74] |
CHENG YY, CHEN H, XUE G. Effect of copper nanoparticles and triclosan on sludge nitrification. Chinese Journal of Environmental Engineering, 2018, 12(2): 513-520.
(in Chinese) 成钰莹, 陈红, 薛罡. 纳米铜及三氯生对污泥硝化作用的影响. 环境工程学报, 2018, 12(2): 513-520. |
| [75] | HUANGFU XL, XU YH, LIU CH, HE Q, MA J, MA CX, HUANG RX. A review on the interactions between engineered nanoparticles with extracellular and intracellular polymeric substances from wastewater treatment aggregates. Chemosphere, 2019, 219: 766-783. |
| [76] | ZHENG X, SU YL, CHEN YG. Acute and chronic responses of activated sludge viability and performance to silica nanoparticles. Environmental Science & Technology, 2012, 46(13): 7182-7188. |
| [77] |
ZHANG XJ, ZHOU Y, FU HQ, CHEN T, ZHANG RR, ZHANG J, ZHANG J. Short-term and long-term effects of Cu nanoparticles on partial nitrification process. Journal of Harbin Institute of Technology, 2018, 50(8): 14-19.
(in Chinese) 张肖静, 周月, 傅浩强, 陈涛, 张蓉蓉, 张俊, 张杰. 纳米铜对自养脱氮亚硝化工艺的短期及长期影响. 哈尔滨工业大学学报, 2018, 50(8): 14-19. |
| [78] | HE TX, CHEN MP, DING CY, WU QF, ZHANG MM. Hypothermia Pseudomonas taiwanensis J488 exhibited strong tolerance capacity to high dosages of divalent metal ions during nitrogen removal process. Bioresource Technology, 2021, 341: 125785. |
| [79] | YE JY, GAO H, WU JK, CHANG Y, CHEN ZK, YU R. Responses of nitrogen transformation processes and N2O emissions in biological nitrogen removal system to short-term ZnO nanoparticle stress. Science of the Total Environment, 2020, 705: 135916. |
| [80] | HE TX, XIA DT, NI JP, LI ZL. Ca(II) and Mg(II) significantly enhanced the nitrogen removal capacity of Arthrobacter arilaitensis relative to Zn(II) and Ni(II). Journal of Hazardous Materials, 2019, 368: 594-601. |
| [81] | YANG YR, ZHANG C, LI KL, LI ZL. Fe2+ alleviated the toxicity of ZnO nanoparticles to Pseudomonas tolaasii Y-11 by changing nanoparticles behavior in solution. Microorganisms, 2021, 9(11): 2189. |
| [82] | DJURIŠIĆ AB, LEUNG YH, NG AMC, XU XY, LEE PKH, DEGGER N, WU RSS. Toxicity of metal oxide nanoparticles: mechanisms, characterization, and avoiding experimental artefacts. Small: Weinheim an Der Bergstrasse, Germany, 2015, 11(1): 26-44. |
| [83] | SLAVIN YN, ASNIS J, HÄFELI UO, BACH H. Metal nanoparticles: understanding the mechanisms behind antibacterial activity. Journal of Nanobiotechnology, 2017, 15(1): 65. |
| [84] | DROBNE D, JEMEC A, PIPAN TKALEC Ž. In vivo screening to determine hazards of nanoparticles: nanosized TiO2. Environmental Pollution, 2009, 157(4): 1157-1164. |
| [85] | GHOSH S, MASHAYEKHI H, BHOWMIK P, XING BS. Colloidal stability of Al2O3 nanoparticles as affected by coating of structurally different humic acids. Langmuir, 2010, 26(2): 873-879. |
| [86] | ZHANG RJ, XU XM, LYU YT, ZHOU Y, CHEN Q, SUN WL. Impacts of engineered nanoparticles and antibiotics on denitrification: element cycling functional genes and antibiotic resistance genes. Ecotoxicology and Environmental Safety, 2022, 241: 113787. |
| [87] | ShENG GP, YU HQ, LI XY. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems: a review. Biotechnology Advances, 2010, 28(6): 882-894. |
| [88] | TANG J, WU YH, ESQUIVEL-ELIZONDO S, SØRENSEN SJ, RITTMANN BE. How microbial aggregates protect against nanoparticle toxicity. Trends in Biotechnology, 2018, 36(11): 1171-1182. |
| [89] | YOU GX, HOU J, XU Y, WANG C, WANG PF, MIAO LZ, AO YH, LI Y, LV BW. Effects of CeO2 nanoparticles on production and physicochemical characteristics of extracellular polymeric substances in biofilms in sequencing batch biofilm reactor. Bioresource Technology, 2015, 194: 91-98. |
| [90] |
LI YJ, WANG SP, LIU L, JIA LY. Secretory characteristics of eps and the signal molecules release under different organic loading. Environmental Engineering, 2022, 40(2): 47-52.
(in Chinese) 李亚静, 王少坡, 刘璐, 贾丽媛. 有机负荷对污泥胞外聚合物(EPS)分泌特性及信号分子释放差异的影响. 环境工程, 2022, 40(2): 47-52. |
| [91] | KHAN R, INAM MA, KHAN S, JIMÉNEZ AN, PARK DR, YEOM IT. The influence of ionic and nonionic surfactants on the colloidal stability and removal of CuO nanoparticles from water by chemical coagulation. International Journal of Environmental Research and Public Health, 2019, 16(7): 1260. |
| [92] | LI M, ZHU LZ, LIN DH. Toxicity of ZnO nanoparticles to Escherichia coli: mechanism and the influence of medium components. Environmental Science & Technology, 2011, 45(5): 1977-1983. |
 2023, Vol. 63
2023, Vol. 63