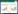中国科学院微生物研究所,中国微生物学会
文章信息
- 王利飞, 谭子瑊, 谢希贤, 朱蕾蕾. 2023
- WANG Lifei, TAN Zijian, XIE Xixian, ZHU Leilei.
- 塔格糖-4-异构酶的新酶挖掘及酶学性质研究
- Discovery and characterization of a novel tagatose-4-epimerase
- 微生物学报, 63(11): 4197-4207
- Acta Microbiologica Sinica, 63(11): 4197-4207
-
文章历史
- 收稿日期:2023-03-19
- 网络出版日期:2023-07-27
2. 中国科学院天津工业生物技术研究所 低碳合成工程生物学重点实验室, 天津 300308;
3. 南京中医药大学药学院, 江苏 南京 210023
2. Key Laboratory of Engineering Biology for Low-carbon Manufacturing, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, Jiangsu, China
D-塔格糖由于具有良好的理化特性及生物学功能广泛受到人们的喜爱[1]。经研究发现,D-塔格糖是一种热量极低的糖,口感与蔗糖非常接近,甜度为蔗糖的90%[2],但塔格糖具有的热量约为蔗糖的三分之一(塔格糖和蔗糖的热量分别为1.5 kcal/g和4 kcal/g)[3],是理想的蔗糖替代品。D-塔格糖最先是由Bruyn和Ekenstein于1897年研究温和碱对D-半乳糖的影响时发现的[4],它是一种还原己酮糖[5],分别是D-果糖和D-半乳糖的差向异构体和同分异构体。在新兴的营养食品中,D-塔格糖由于具有预防肥胖[6]、降血糖[7]、防龋齿[8]和益生等生理功能,可应用于烘焙食品、巧克力、牛奶饮料、酸奶和糖果等食品生产过程中[9]。D-塔格糖除了在食品行业应用较广外,在医药行业也有非常好的应用前景。D-塔格糖可以通过抑制小肠黏膜上的部分转运酶来抑制肥胖,同时由于在摄入D-塔格糖时只有15%‒20%能被小肠吸收[10],因此可作为糖尿病患者饮食的甜味剂。当D-塔格糖被小肠部分吸收后,其余的塔格糖则被结肠中的肠道菌群发酵,具有很好的益生作用[11],有利于肠道健康。但是D-塔格糖在天然食品物质中存在的量非常少[12],通过提取法生产塔格糖比较困难。目前D-塔格糖生产主要依靠人工合成,通常有化学和生物转化2种合成方法[13]。
化学合成D-塔格糖是以半乳糖为底物,碱金属盐作为催化剂,使半乳糖与金属氢氧化物发生异构化反应,生成金属氢氧化物-塔格糖复合物中间体沉淀,再用酸中和[14]。在中和过程中,酸与D-塔格糖反应生成不溶性盐,通过过滤、纯化使塔格糖分离出来。化学法生产D-塔格糖成本高,纯化步骤复杂,产物纯度低[15],并且会有化学废物和副产物形成。因此,酶催化的生物法合成D-塔格糖成为相关领域的研究重点,如D-半乳糖通过L-阿拉伯糖异构酶将D-半乳糖转化为D-塔格糖;D-山梨糖通过D-阿洛酮糖-3-差向异构酶转化成D-塔格糖;半乳糖醇2-脱氢酶以D-半乳糖醇为底物,实现D-塔格糖的生成[16]。但由于这几种酶方法受到底物昂贵、价格不稳定的限制[17],因此缺乏工业应用价值。与D-半乳糖、D-山梨糖和半乳糖醇相比,D-果糖供应更稳定,成本更低,是生产D-塔格糖的理想底物。
2017年,Lee等[18]首次以果糖为底物通过己糖激酶、果糖-1, 6-二磷酸醛缩酶和植酸酶的三步酶联级反应产塔格糖:再将含有塔格糖和果糖的反应混合物通过乙醇重结晶纯化为高纯度的塔格糖。这种方法步骤较为繁琐,限制因素较多。此后,韩国建国大学的Oh教授团队[19]通过对石生嗜热袍菌(Thermotoga petrophila)来源的D-tagaturonate epimerase (UxaE)进行定向改造使其获得塔格糖-4-差向异构活性,从而可以直接将D-果糖转化为D-塔格糖。塔格糖-4-差向异构酶催化果糖转化为塔格糖的过程如图 1所示。这种利用塔格糖-4-差向异构酶直接将果糖一步转化为塔格糖的方法成本低廉,为D-塔格糖的经济商业化生产提供了一条理想的途径。但是受限于较低的酶活力,目前仍难以满足工业需求。因此,新的塔格糖-4-差向异构酶的鉴定与活性改造工作非常重要。由于目前没有发现天然的塔格糖-4-差向异构酶,新阿波罗栖热袍菌(Thermotoga neapolitana)来源的D-tagaturonate epimerase (UxaE)被证实经过氨基酸突变可以获得的塔格糖-4-差向异构的活性[3],因此本研究以该UxaE的氨基酸序列作为模板进行BLAST搜索,本文使用BLASTp功能对塔格糖-4-差向异构酶进行新基因挖掘,并将重组质粒转入大肠杆菌(Escherichia coli) BL21(DE3)进行表达,对目标酶纯化后进一步进行酶学性质研究,进而对其催化果糖到塔格糖的过程进行优化,从而为塔格糖-4-差向异构酶转化果糖为塔格糖的应用提供参考。
|
| 图 1 塔格糖-4-差向异构酶催化果糖向塔格糖转化示意图 Figure 1 Schematic diagram of tagatose-4-epimerase catalyzed the conversion of fructose to tagatose. |
1 材料与方法 1.1 材料和试剂 1.1.1 菌株和质粒
表达菌株E. coli BL21(DE3)与pET21a (+)质粒由本实验室保存;含有塔格糖-4-差向异构酶基因的重组质粒pET21a-mbn1、pET21a-hcz0委托中国科学院天津工业生物技术研究所合成。
1.1.2 培养基Luria-Bertani (LB)液体培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10。
LB固体培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,琼脂粉2。
1.1.3 试剂氨苄青霉素(ampicillin, Amp)购自北京兰博利德商贸有限公司、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)购自北京索莱宝科技有限公司、质粒小提试剂盒购自天根生化科技(北京)有限公司。
1.2 仪器与设备Ultimate 3000液相色谱仪,戴安中国有限公司;酶标仪,Molecular Devices公司;Mastercycler Personal PCR仪,Eppendorf公司;Quantum ST5凝胶成像系统,Viber公司;真空冷冻干燥机,博医康(北京)仪器有限公司;恒温摇床,上海知楚仪器有限公司;高压灭菌锅,上海伯能仪器有限公司。
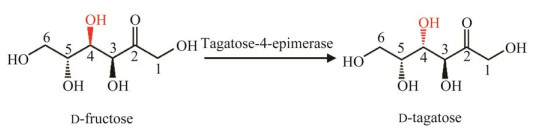
1.3 塔格糖-4-异构酶的基因挖掘以来源于T. neapolitana的UxaE氨基酸序列为模板,使用BLASTp功能在美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)的非冗余蛋白质序列数据库中进行检索,选择序列一致性靠前的100条序列。使用MEGA软件进行多序列比对,去除不合群序列。使用邻接法将剩余序列构建系统发育树。选用步长检验的检验方法,设置检验次数为1 000。距离模型选择p-distance,部分删除多序列比对中含有空位的列。最终得到的步长检验合并树大多数的节点可信度大于70%。进而通过考虑分支、序列和来源等因素选择2条候选塔格糖异构酶序列分别命名为HCZ0、MBN1。
1.4 塔格糖-4-差向异构酶的表达与纯化将塔格糖差向异构酶表达载体pET21a-hcz0,pET21a-mbn1转入E. coli BL21(DE3)中,涂布平板,过夜培养长出单克隆菌落。挑取单菌落于20 mL LB培养基中培养过夜(12–16 h),以1% (体积分数)的接种量接种到1 L LB培养基中,37 ℃、220 r/min摇床培养至OD600=0.6–0.8,加入诱导剂IPTG,使其终浓度为0.1 mmol/L,20 ℃继续培养24 h。培养完成后,使用5 000 r/min低温高速离心机收集菌体,去除上清。去离子水重悬洗涤菌体2次,除去残余LB成分。用适当体积Tris-HCl缓冲液(50 mmol/L,pH值8.0)重悬并用高压均质仪在1 000 bar压力下破碎菌体,破碎时间为5–10 min。之后使用12 000 r/min低温高速离心机收集上清的可溶性粗酶液。将粗酶液用0.22 µm滤膜过滤处理后,使用Ni Sepharose 6 Fast Flow His标签蛋白纯化填料自填装镍柱为层析柱;缓冲系统A液:10 mmol/L咪唑和500 mmol/L NaCl的50 mmol/L Tris-HCl (pH 8.0);B液:250 mmol/L咪唑和500 mmol/L NaCl的50 mmol/L Tris-HCl (pH 8.0)。使用AKTA仪器进行纯化,利用不同浓度的咪唑进行梯度洗脱获得纯化蛋白。为降低咪唑对蛋白的影响,将纯化后的蛋白再经脱盐柱处理,除去咪唑后采用二辛可宁酸法(bicinchoninic acid assay, BCA)测定蛋白浓度。纯酶液最终保存在Tris-HCl缓冲液(50 mmol/L,pH 9.0)中。
1.5 塔格糖-4-差向异构酶的活性测定塔格糖和果糖浓度标准曲线的制定:先配制浓度为120 g/L的塔格糖母液和400 g/L的果糖母液,再稀释成一系列浓度的塔格糖和果糖标准液,通过高效液相色谱(high performance liquid chromatography, HPLC)检测并绘制标曲。检测条件为:色谱柱Water Sugar-PakTMI,流动相ddH2O,流速0.4 mL/min,柱温80 ℃,示差折光检测器;上样量为20 μL。
HCZ0酶活的测定:70 μL的果糖溶液(终浓度50 g/L)与70 μL的HCZ0酶液混合均匀后,置于70 ℃反应90 min后,加入5 μL 10% H2SO4终止反应。冷却至室温,反应液经0.22 μm膜过滤后通过HPLC检测塔格糖产量。
比酶活的测定:70 μL的果糖溶液(终浓度100 g/L)与70 μL的HCZ0酶液或UxaE酶液分别混合均匀后,置于70 ℃反应15 min后,加入5 μL 10% H2SO4终止反应。冷却至室温,反应液经0.22 μm膜过滤后通过HPLC检测塔格糖产量。
酶活力单位定义为:每分钟转化果糖生成1 μmol塔格糖的酶量。
1.6 酶催化反应的最适pH测定塔格糖-4-差向异构酶在碱性环境中活性较高[19],因此选用偏碱性的缓冲液检测其最适pH。用50 mmol/L的不同pH的Tris-HCl缓冲液(pH值8.0‒9.0)以及碳酸盐缓冲液(pH值9.5–11.0)配制果糖溶液,并稀释酶液,在70 ℃下根据1.5方法测定不同pH条件下的酶活力,绘制最适pH曲线。
1.7 酶催化反应的最适温度和温度稳定性研究将1.5中的酶活力测定温度设置为50–90 ℃范围内的5个温度,分别测定酶活力,绘制酶活力随温度变化曲线。酶催化的温度稳定性则将蛋白定量到1 mg/mL,取500 μL的纯酶液分别置于60、70和80 ℃金属浴加热不同时间,测定其残余活性并绘制热失活曲线来研究。
1.8 金属离子、金属离子浓度对塔格糖-4-差向异构酶酶活的影响配制Ca2+、Zn2+、Ni2+、Mn2+和Mg2+金属离子溶液,加入酶催化的反应体系,使得金属离子终浓度为1 mmol/L,检测不同金属离子对酶活的影响。设置最适金属离子终浓度为0.5、1、2、4和5 mmol/L的反应体系,检测该金属离子的浓度对酶活的影响,并确定最适金属离子的反应最佳浓度。
1.9 塔格糖-4-差向异构酶HCZ0动力学参数测定使用Tris-HCl缓冲液(50 mmol/L,2 mmol/L NiCl2,pH值9.0)将塔格糖-4-差向异构酶液稀释到1 mg/mL。在1.5 mL EP管中加入70 μL酶溶液,再加入等体积的一系列不同浓度的果糖溶液。在金属振荡器70 ℃下反应,分别设置不同的反应时间。反应结束后,按照1.5条件中的液相检测条件进行检测,并进行动力学曲线的拟合和动力学参数的计算。初始速率数据拟合变构Hill方程v=Vmax×Sn/(Khalfn+Sn),式中:v为初始速度;S为底物浓度;Vmax为最大速度;Khalf为占据一半活性位点的配体浓度(半饱和浓度);n为Hill系数。
1.10 塔格糖-4-差向异构酶HCZ0转化率测定使用Tris-HCl缓冲液(50 mmol/L,2 mmol/L NiCl2,pH值9.0)将塔格糖-4-差向异构酶液稀释到36 mg/mL,在1.5 mL EP管中加入70 μL酶溶液,再加入等体积的400 g/L果糖溶液。在金属振荡器70 ℃下反应,每间隔1 h取样,直至转化率达到最大。反应结束后,按照1.5条件中的液相检测条件检测塔格糖产量与果糖剩余量,并计算转化率。
2 结果与分析 2.1 塔格糖-4-差向异构酶的挖掘自然界未发现天然的塔格糖-4-差向异构酶,已知T. neapolitana来源的UxaE经过氨基酸突变可以获得的塔格糖-4-差向异构的活性[3],因此本研究以该UxaE的氨基酸序列作为模板进行BLAST搜索,对获得的蛋白序列构建系统进化树(图 2)。选择了与模板序列距离较近和较远的2条嗜热菌来源的新蛋白在E. coli BL21(DE3)中表达并验证功能,分别将2个蛋白称为MBN1 (来源于Thermoflexales bacterium的假定蛋白)和HCZ0 (来源于热袍菌(Thermotogae bacterium)的假定蛋白)。MBN1和HCZ0的理论分子量分别为53.1 kDa和57.9 kDa,与UxaE的序列一致性分别为44%和48%。
|
| 图 2 以Thermotoga neapolitana来源的UxaE的氨基酸序列为模板进行BLAST搜索获得的蛋白序列构建系统进化树 Figure 2 Phylogenetic tree of protein sequences obtained by BLAST search using UxaE as query sequence. |
2.2 塔格糖-4-差向异构酶的表达纯化
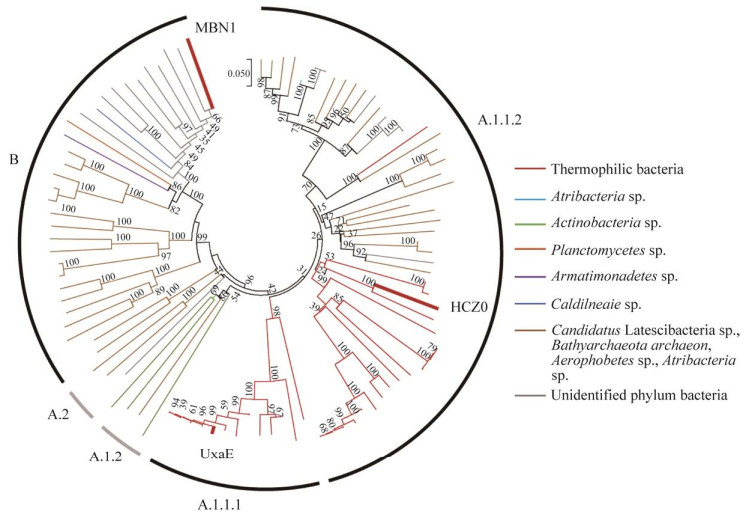
首先通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分析MBN1和HCZ0在E. coli BL21(DE3)中的可溶性表达情况。根据图 3A可知,候选酶MBN1与pET21a(+)空载相比,在45–65 kDa之间没有看到条带表达,因此判断MBN1在E. coli BL21(DE3)中无可溶性表达;根据图 3B可知,与pET21a(+)空载相比,HCZ0在分子量45–65 kDa处有明显条带,大小与理论分子量(57.9 kDa)一致,因此判断HCZ0在E. coli BL21(DE3)中可溶性表达较好。进一步通过AKTA纯化,获得了纯度较高的HCZ0纯酶(图 3C),可用于接下来的酶学性质研究。
|
| 图 3 SDS-PAGE分析MBN1 (A)和HCZ0 (B)的可溶性表达与HCZ0的纯化(C) Figure 3 SDS-PAGE analysis of soluble expression of MBN1(A) and HCZ0 (B), and the purification efficiency of HCZ0 (C). 1: Protein Marker; 2: pET21a(+); 3: pET21a-MBN1 crude enzyme supernatant; 4: pET21a (+); 5: pET21a-HCZ0 crude enzyme supernatant; 6: HCZ0 crude enzyme supernatant; 7: Purified HCZ0 enzyme. |
2.3 反应最适pH
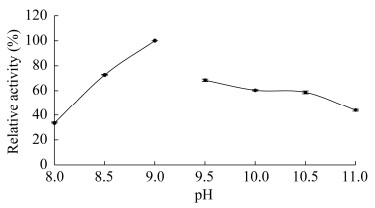
分别在pH值8.0‒11.0条件下进行HCZ0催化果糖转化为塔格糖的试验,发现该酶可以将果糖转化为塔格糖,因此命名为塔格糖-4-差向异构酶HCZ0。以pH值9.0时的最高活性为100%分别计算其他pH值条件下的相对活性。结果如图 4所示:pH值8.0–9.0时,HCZ0催化果糖转化为塔格糖的酶活力随着pH值的升高而增加,pH值9.0时达到最大酶活力,pH值9.5–11.0时酶活力随着pH值的升高而降低,但下降缓慢。由此可知,HCZ0更适宜在偏碱性环境下催化果糖转化为塔格糖。
|
| 图 4 HCZ0酶活力随反应pH的变化 Figure 4 The enzyme activity of HCZ0 changes with reaction pH. |
2.4 最适温度和温度稳定性
在最适pH值9.0,反应温度50–90 ℃的条件下,利用HCZ0催化果糖转化,检测塔格糖产量并计算酶活力。由图 5A可知,50–70 ℃,随着温度的升高,HCZ0催化果糖转化为塔格糖的酶活力呈上升趋势,在70 ℃达到最高;温度继续升高,酶活力则呈下降趋势。因此HCZ0催化果糖转化为塔格糖的最适反应温度为70 ℃。为了进一步检测HCZ0的温度稳定性,将HCZ0纯酶液在60、70和80 ℃孵育不同时间检测其剩余活性。发现HCZ0在60 ℃和70 ℃具有较好的耐热性,由图 5B可知60 ℃孵育113 h,酶活力仅下降18%,孵育113–145 h酶活力维持稳定,继续热孵育至168 h仍剩余60%的活性。孵育180 h时酶活力下降至51%,可知HCZ0在60 ℃的半衰期大致为180 h。在70 ℃孵育39 h后,相对活性剩余87%,继续孵育至61 h,活性剩余57%。孵育至67 h时,相对活性为初始活性的52%,因此判断在70 ℃的半衰期约为67 h。当酶在80 ℃孵育时,孵育9 h后活性降为初始活性的44%,因此判断在80 ℃的半衰期略小于9 h。

|
| 图 5 HCZ0催化活力随反应温度变化曲线(A)和60、70和80 ℃热稳定性曲线(B) Figure 5 The curve of changes in catalytic activity of HCZ0 with respect to reaction temperature (A) and thermal stability curve at 60, 70, and 80 ℃ (B). |
2.5 最适金属离子和最适金属离子浓度
金属离子经常作为酶促反应的辅助因子,因此在酶促反应过程中经常添加某些金属离子来促进酶促反应的进行[20]。在果糖异构化酶促反应中添加各种金属离子,检测HCZ0活性。从表 1可以看出,HCZ0催化果糖异构化为塔格糖的反应依赖金属离子的激活作用,其中Ni2+对HCZ0酶活力的激活作用最强,产塔格糖量为2.752 2 g/L。Mn2+、Zn2+对酶活性的激活作用次之,产塔格糖量分别为0.479 8 g/L和0.282 3 g/L,Ca2+、Mg2+对酶的激活作用最小,产塔格糖量分别为0.047 0 g/L和0.050 0 g/L。因此,HCZ0催化果糖异构化为塔格糖的最适金属离子是Ni2+。
| Metal ions | Yield of tagatose (g/L) |
| None | 0.000 0±0.000 0 |
| Ca2+ | 0.047 0±0.000 1 |
| Zn2+ | 0.282 3±0.007 6 |
| Ni2+ | 2.752 2±0.017 9 |
| Mn2+ | 0.479 8±0.001 0 |
| Mg2+ | 0.050 0±0.000 1 |
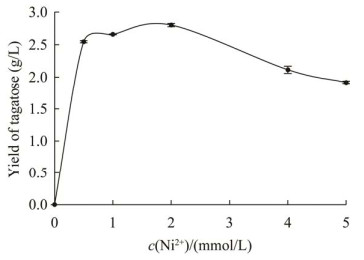
为了进一步研究Ni2+浓度对酶活性的影响,检测了添加5种不同浓度Ni2+时HCZ0的酶活力。结果如图 6所示,在Ni2+浓度0–2 mmol/L范围内,HCZ0酶活力随着Ni2+浓度增加而提高,Ni2+浓度为2–5 mmol/L范围内时,HCZ0酶活力随着Ni2+浓度增加而降低。因此HCZ0催化目标反应的最佳Ni2+浓度是2 mmol/L。
|
| 图 6 不同Ni2+浓度条件下HCZ0的相对酶活力 Figure 6 The relative enzymatic activity of HCZ0 under different Ni2+ concentrations. |
2.6 塔格糖-4-差向异构酶HCZ0的动力学参数
为了表征塔格糖-4-差向异构酶HCZ0的动力学参数表征,按照1.9方法检测了不同底物浓度下的反应初速度,并使用GraphPad Prism软件对动力学曲线进行拟合和分析。经过计算,HCZ0的动力学参数如表 2所示,kcat为15.32 min‒1,kcat/Khalf为99.566 L/(min·mol)。
| Enzyme | kcat (min‒1) | Khalf (mol/L) | kcat/Khalf (L/(min·mol)) |
| HCZ0 | 15.32±0.27 | 0.154±0.002 | 99.566±0.751 |
2.7 塔格糖-4-差向异构酶HCZ0转化率
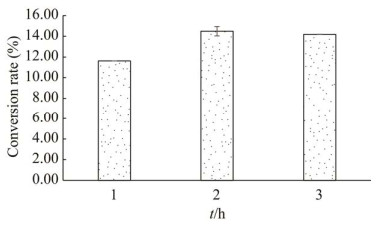
在最优反应条件(反应温度70 ℃、pH值9.0、2 mmol/L Ni2+)下进行反应,检测塔格糖-4-差向异构酶HCZ0的底物转化率,结果如图 7所示,当酶量终浓度为18 mg/mL时,HCZ0在2 h内催化200 g/L果糖生成28 g/L塔格糖,最大转化率为14%,产率为14 g/(L·h)。据此数据计算得出的反应平衡常数为0.17。
|
| 图 7 HCZ0在优化条件下的转化率 Figure 7 The conversion rate of HCZ0 in the optimized condition. |
2.8 塔格糖-4-差向异构酶HCZ0和UxaE比酶活比较
在酶量终浓度为0.5 mg/mL、果糖终浓度为100 g/L的条件下测定HCZ0和UxaE的比酶活。结果显示,来源于T. neapolitana的UxaE经分子改造后的最佳突变体10V和HCZ0的比酶活分别为1.7 U/mg和0.9 U/mg。
3 讨论与结论D-塔格糖是一种具有多种生理功能的稀有糖,更是一种非常具有前景的功能甜味剂[21-22]。酶法作为生产塔格糖的主要途径,成本较低、产物纯度高,必将成为一种趋势。D-果糖作为D-塔格糖的C-4差向异构体,市场供应量大,将D-果糖用于D-塔格糖的合成,可以进一步降低酶法生产D-塔格糖的成本[23]。因此酶催化的C-4-差向异构反应对于塔格糖的合成十分重要。然而在以果糖为底物的酶法催化合成策略中,关于C-4-差向异构酶的研究较少,需要对C-4-差向异构新酶的发掘进行研究。
本研究分别选择了与模板UxaE序列[3]距离较近和较远的2条嗜热菌来源的新酶基因在E. coli BL21(DE3)中表达并验证功能,发现了与模板序列距离较近的新酶HCZ0具有塔格糖-4-差向异构活性,能够有效地催化廉价底物果糖转化为塔格糖。本研究也检测了来源于T. neapolitana的UxaE经分子改造后的最佳突变体10V和HCZ0的比酶活,分别为1.7 U/mg和0.9 U/mg。来自T. petrophila的塔格糖-4-差向异构野生酶活力为0.000 6 U/mg,分子改造后最佳突变体5V的比活力为0.12 U/mg[19]。因此,HCZ0与已报道具有活性的野生酶相比具有更高的改造潜力。此外,与其他酶法生产塔格糖途径中的关键酶相比,HCZ0更优良的热稳定性使其具有更好的工业化应用前景,在60 ℃下孵育113 h后,活性为初始活性的82%。而催化果糖-6-磷酸生产塔格糖途径的关键酶塔格糖1, 6-二磷酸醛缩酶在60 ℃下孵育30 h后,相对活性为初始活性的70%[24]。本研究中对HCZ0催化果糖转化为塔格糖的反应温度、pH、金属离子种类和最佳金属离子浓度进行的一系列优化也为其进一步改造与应用奠定了基础。优化条件后,HCZ0可催化200 g/L果糖在2 h内生成28 g/L塔格糖,转化率为14%,产率为14 g/(L·h)。
| [1] | FUJIMARU T, PARK JH, LIM J. Sensory characteristics and relative sweetness of tagatose and other sweeteners[J]. Journal of Food Science, 2012, 77(9): S323-S328. |
| [2] | ADACHI S, MIYAGAWA Y, KOBAYASHI T. Production of tagatose from galactose in a batch-type reactor using a phosphate buffer under subcritical water conditions[J]. Food Science and Technology Research, 2020, 26(6): 695-699 DOI:10.3136/fstr.26.695. |
| [3] |
YANG SJ, LEE YM, PARK IH, LEE CH, CHO HK, KIM SB, KIM YH, PARK SW. Hexuronate C4-epimerase variant having improved D-tagatose conversion activity, and D-tagatose production method using same: CN108884454A[P]. 2018-11-23 (in Chinese). 梁成才, 李英美, 朴逸香, 李赞炯, 赵显国, 金成俌, 金良姬, 朴承源. 具有改良的D-塔格糖转化活性的己糖醛酸酯C4-差向异构酶变异体和用它制造D-塔格糖的方法: CN108884454A[P]. 2018-11-23. |
| [4] | BAPTISTA SL, ROMANÍ A, OLIVEIRA C, FERREIRA S, ROCHA CMR, DOMINGUES L. Galactose to tagatose isomerization by the L-arabinose isomerase from Bacillus subtilis: a biorefinery approach for Gelidium sesquipedale valorisation[J]. LWT, 2021, 151: 112199 DOI:10.1016/j.lwt.2021.112199. |
| [5] | HAN PP, WANG XY, LI YJ, WU H, SHI T, SHI JF. Synthesis of a healthy sweetener D-tagatose from starch catalyzed by semiartificial cell factories[J]. Journal of Agricultural and Food Chemistry, 2023, 71(8): 3813-3820 DOI:10.1021/acs.jafc.2c08400. |
| [6] | CHAHED A, NESLER A, AZIZ A, BARKA EA, PERTOT I, PERAZZOLLI M. A review of knowledge on the mechanisms of action of the rare sugar D-tagatose against phytopathogenic oomycetes[J]. Plant Pathology, 2021, 70(9): 1979-1986 DOI:10.1111/ppa.13440. |
| [7] | CAMPBELL HR, ALSHARIF FM, MARSAC PJ, LODDER RA. The development of a novel pharmaceutical formulation of D-tagatose for spray-drying[J]. Journal of Pharmaceutical Innovation, 2022, 17(1): 194-206 DOI:10.1007/s12247-020-09507-4. |
| [8] | MAYUMI S, KUBONIWA M, SAKANAKA A, HASHINO E, ISHIKAWA A, IJIMA Y, AMANO A. Potential of prebiotic D-tagatose for prevention of oral disease[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 767944 DOI:10.3389/fcimb.2021.767944. |
| [9] | GUERRERO-WYSS M, DURÁN AGÜERO S, ANGARITA DÁVILA L. D-tagatose is a promising sweetener to control glycaemia: a new functional food[J]. BioMed Research International, 2018, 2018: 8718053. |
| [10] | CORNEO PE, NESLER A, LOTTI C, CHAHED A, VRHOVSEK U, PERTOT I, PERAZZOLLI M. Interactions of tagatose with the sugar metabolism are responsible for Phytophthora infestans growth inhibition[J]. Microbiological Research, 2021, 247: 126724 DOI:10.1016/j.micres.2021.126724. |
| [11] | YOSHIDA H, YAMADA M, NISHITANI T, TAKADA G, IZUMORI K, KAMITORI S. Crystal structures of D-tagatose 3-epimerase from Pseudomonas cichorii and its complexes with D-tagatose and D-fructose[J]. Journal of Molecular Biology, 2007, 374(2): 443-453 DOI:10.1016/j.jmb.2007.09.033. |
| [12] | ZHANG SS, GUO TT, XIN YP, QIN LH, KONG J. Biotechnological production of D-tagatose from lactose using metabolically engineering Lactiplantibacillus plantarum[J]. LWT, 2021, 142: 110995 DOI:10.1016/j.lwt.2021.110995. |
| [13] | SOKOŁOWSKA E, SADOWSKA A, SAWICKA D, KOTULSKA-BĄBLIŃSKA I, CAR H. A head-to-head comparison review of biological and toxicological studies of isomaltulose, D-tagatose, and trehalose on glycemic control[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(21): 5679-5704 DOI:10.1080/10408398.2021.1895057. |
| [14] | ROY S, CHIKKERUR J, ROY SC, DHALI A, KOLTE AP, SRIDHAR M, SAMANTA AK. Tagatose as a potential nutraceutical: production, properties, biological roles, and applications[J]. Journal of Food Science, 2018, 83(11): 2699-2709 DOI:10.1111/1750-3841.14358. |
| [15] | WANG ZH, WANG MM, LYU XM, WANG CY, TONG YJ., HUA X, YANG RJ. Recycling preparation of high-purity tagatose from galactose using one-pot boronate affinity adsorbent-based adsorption-assisted isomerization and simultaneous purification[J]. Chemical Engineering Journal, 2022, 446: 137089 DOI:10.1016/j.cej.2022.137089. |
| [16] | SUCHÝ M, CHARLTON TA, BEN RN, SHUHENDLER AJ. Synthesis of natural/13C-enriched D-tagatose from natural/13C-enriched D-fructose[J]. Carbohydrate Research, 2021, 507: 108377 DOI:10.1016/j.carres.2021.108377. |
| [17] | JAYAMUTHUNAGAI J, GAUTAM P, SRISOWMEYA G, CHAKRAVARTHY M. Biocatalytic production of D-tagatose: a potential rare sugar with versatile applications[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(16): 3430-3437 DOI:10.1080/10408398.2015.1126550. |
| [18] | LEE SH, HONG SH, KIM KR, OH DK. High-yield production of pure tagatose from fructose by a three-step enzymatic cascade reaction[J]. Biotechnology Letters, 2017, 39(8): 1141-1148 DOI:10.1007/s10529-017-2340-3. |
| [19] | SHIN KC, LEE TE, SEO MJ, KIM DW, KANG LW, OH DK. Development of tagaturonate 3-epimerase into tagatose 4-epimerase with a biocatalytic route from fructose to tagatose[J]. ACS Catalysis, 2020, 10(20): 12212-12222 DOI:10.1021/acscatal.0c02922. |
| [20] | ZHANG LT, MU WM, JIANG B, ZHANG T. Characterization of D-tagatose-3-epimerase from Rhodobacter sphaeroides that converts D-fructose into D-psicose[J]. Biotechnology Letters, 2009, 31(6): 857-862 DOI:10.1007/s10529-009-9942-3. |
| [21] | WILLIAMS J, SPITNALE M, LODDER R. The effect of D-tagatose on fructose absorption in a rat model[J]. Journal of Developing Drugs, 2013, 2: 1000111. |
| [22] | UECHI K, TAKATA G, YONEDA K, OHSHIMA T, SAKURABA H. Structure of D-tagatose 3-epimerase-like protein from Methanocaldococcus jannaschii[J]. Acta Crystallographica Section F, Structural Biology Communications, 2014, 70(Pt 7): 890-895. |
| [23] | DURANTE M, SGAMBELLONE S, LUCARINI L, FAILLI P, LAURINO A, COLLOTTA D, PROVENSI G, MASINI E, COLLINO M. D-tagatose feeding reduces the risk of sugar-induced exacerbation of myocardial I/R injury when compared to its isomer fructose[J]. Frontiers in Molecular Biosciences, 2021, 8: 650962 DOI:10.3389/fmolb.2021.650962. |
| [24] | DAI YW, ZHANG JX, ZHANG T, CHEN JJ, HASSANIN HA, JIANG B. Characteristics of a fructose 6-phosphate 4-epimerase from Caldilinea aerophila DSM 14535 and its application for biosynthesis of tagatose[J]. Enzyme and Microbial Technology, 2020, 139: 109594 DOI:10.1016/j.enzmictec.2020.109594. |
 2023, Vol. 63
2023, Vol. 63