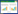中国科学院微生物研究所,中国微生物学会
文章信息
- 许晓毅, 崔佳豪, 白净, 王斌, 陈小宾, 贺志敏, 温妍. 2023
- XU Xiaoyi, CUI Jiahao, BAI Jing, WANG Bin, CHEN Xiaobin, HE Zhimin, WEN Yan.
- 两株多环芳烃降解菌协同对菲-镉污染的去除特性
- Synergistic removal of phenanthrene and cadmium by two polycyclic aromatic hydrocarbon-degrading bacteria
- 微生物学报, 63(1): 283-296
- Acta Microbiologica Sinica, 63(1): 283-296
-
文章历史
- 收稿日期:2022-04-26
- 网络出版日期:2022-07-28
2. 苏州科技大学化学与生命科学学院, 江苏 苏州 215009;
3. 贵州大学土木工程学院, 贵州 贵阳 550025
2. School of Chemistry and Life Sciences, Suzhou University of Science and Technology, Suzhou 215009, Jiangsu, China;
3. School of Civil Engineering, Guizhou University, Guiyang 550025, Guizhou, China
典型持久性“三致”化合物的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)与重金属(heavy metals, HMs)在环境介质中共存而导致的复合污染,已成为石油化工、焦化冶炼及电子垃圾拆解等行业较普遍的污染特征[1-2]。已报道的PAHs超过200种,萘、菲、荧蒽和芘等PAHs化合物被列为优先控制重点污染物[3-4]。PAHs和HMs均具有细胞致毒效应[5],由此引起土壤、水体中复合污染对生态环境和人类健康造成的安全风险日益增加。寻找新方法实现PAHs和HMs复合污染的有效修复日益受到研究人员关注[6]。
现有污染治理技术中,不同降解菌协同的微生物修复因其低成本和环境友好等优势,被认为具有潜力且值得推行[7]。Wanapaisan等[8]采用混合功能菌协同降解芘,认为混菌体系的协同代谢导致酶和细胞代谢功能的变化。相较于单一的铜绿假单胞菌,人工构建的大肠杆菌和铜绿假单胞菌混菌体系被证实能够将菲的降解效率提高26%[9]。也有研究发现,使用2株假单胞菌构成的混菌体系可以促进石油含硫化物的脱硫作用[10]。目前,有关利用微生物进行难降解有机物-重金属复合污染修复过程特性的研究成果较为缺乏。Huang等[11]发现Pseudomonas brassicacearum LZ-4降解萘的同时促进了Cr6+的还原。Fusarium solani被证实在代谢芘的同时产生了铁载体类化合物固定铜、锌和镉等重金属[12]。研究人员在培养基中加入0.45 mmol/L的Fe3+使Rhodococcus ruber L9降解芘的效率提高38.7%[13]。在低于最小抑制浓度的条件下,V5+和Fe2+共存不影响细菌对氯氰菊酯的生物转化效率[14]。另一方面,由于研究体系、降解菌种属与实验条件等差异,重金属胁迫下复合污染物去除效能与微生物生理生化特性的关联机制亦较为复杂。Liu等[15]研究了Pb2+对Bacillus sp. P1降解菲的影响,发现高浓度Pb2+的存在不会改变菲的代谢途径,但会减少代谢产物的产量。Ma等[16]认为,尽管Cu2+胁迫抑制了假单胞菌降解四溴双酚A的代谢产物转化,但对四溴双酚A的最终降解率没有影响。因此,通过适宜的降解菌协同体系降低重金属胁迫对微生物降解难降解有机物行为的不利影响,以实现复合污染的高效修复,值得深入探讨。
镉(cadmium, Cd)生态毒性强且普遍存在于PAHs污染的环境介质中[17],本研究以菲作为PAHs模型化合物,基于镉耐受性具有差异的2株PAHs高效降解菌,构建菲-镉好氧微生物降解体系,研究混菌协同对复合污染体系中目标化合物的去除特性,进一步考察降解周期内污染物去除规律、细胞形态及关键酶活特征对不同镉赋存浓度的响应特性,以期为难降解有机物-重金属复合污染的微生物修复提供菌株资源和应用技术参考。
1 材料与方法 1.1 材料 1.1.1 供试菌株Pseudomonas putida B6-2为革兰氏阴性菌,呈杆状并对卤代芳香烃及混合芳香化合物具有良好降解能力[18-19],由上海交通大学生命科学技术学院提供。Arthrobacter sp. SZ-3从江苏某钢铁厂附近污染土壤中筛选获得。混菌协同体系(文中编号为M)由经过驯化后的B6-2和SZ-3按1:1 (体积比)配比构建,前期培养实验证实2株菌不存在拮抗作用。
1.1.2 培养基和模拟废水(1) LB液体培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,加蒸馏水定容至1 L,调pH至7.0±0.2,121 ℃灭菌30 min。LB培养基主要用于培养种子液和斜面菌种保藏。(2) 模拟废水(g/L):NaNO3 2.0,NaCl 5.0,MgSO4·7H2O 0.25,K2HPO4·3H2O 6.3,KH2PO4 4.0,(NH4)2SO4 1.0,Tween-80 0.2,加蒸馏水定容至1 L后,调pH至7.0±0.2,121 ℃灭菌30 min,添加一定量的菲和镉,摇匀后置于通风橱中过夜待用。
1.2 PAHs降解菌的分离与鉴定 1.2.1 菌株富集和纯化分离称取一定量土样于盛有150 mL无菌水的锥形瓶中,在30 ℃、150 r/min恒温摇床内振荡12 h,静置后用多层无菌纱布过滤,将滤液转接至LB液体培养基扩培。取扩培液5 mL加入含有一定浓度菲、荧蒽和芘的无机盐培养液中培养,培养液(10%)定期转接至菲、荧蒽和芘浓度逐次梯度增加的无机盐培养基中恒温振荡培养,直至溶液出现浑浊。采用稀释平板涂布划线法获得菌落形态单一的纯化菌株。
1.2.2 菌株的鉴定进行菌株革兰氏染色、糖类发酵等生理生化试验。16S rRNA基因PCR扩增测序,采用细菌通用上下游引物27F (5ʹ-AGAGTTTGATC MTGGCTCAG-3ʹ)和1492R (5ʹ-GGTTACCTTG TTACGACTT-3ʹ),由生工生物工程(上海)股份有限公司完成。从GenBank数据库中调取出相似性较高的相关菌株的基因序列进行分析,采用MEGA 7.0软件构建系统进化发育树。
1.3 菌株重金属抗性与耐受性 1.3.1 重金属抗性表征参考Brauner等[20]的方法用最小抑制浓度(minimal inhibit concentration, MIC)表征菌株对重金属的抗性。最小抑制浓度测定:将菌株以1% (体积分数)接种到液体LB培养基中培养12 h,用新鲜灭菌LB培养基稀释作为种子液,接种到含有不同浓度的CdCl2的新鲜LB液体培养基中,于28 ℃恒温培养箱培养48 h后,接种至LB琼脂平板上,根据有无单克隆生长进行评估。
1.3.2 耐受性的测定参考Chen等[21]的方法以微生物生长滞后期的长度表示耐受性。将接种液接种到含有不同浓度CdCl2的新鲜LB液体培养基中,初始OD600≈0.01,每隔2 h测定1次OD600值。当OD600值达到0.1 (定义为开始增长)时,完成测定。
1.4 菲-镉去除特性实验 1.4.1 批次实验设计无菌条件下,按接种比10% (体积分数)将菌液接种到不同浓度镉赋存的模拟废水摇瓶中,无菌透气膜封口,在30 ℃、150 r/min摇床中避光振荡10 d,不同时间取样检测。各批次实验组菲初始浓度均为30 mg/L,镉浓度分别为0、0.5、10、25和50 mg/L,设置不加菌的空白组以扣除由于挥发及器壁吸附等原因导致的菲、镉非生物性损失,空白组其他条件与各实验组一致。
1.4.2 菲和镉的检测菲浓度利用Agilent 1260高效液相色谱进行分析。色谱检测条件为:C18色谱柱(5 μm,250 mm×4.6 mm),紫外检测器,检测波长为254 nm,温度25 ℃,乙腈:超纯水(80:20,体积比)作为流动相,流速为1.5 mL/min,进样量5 μL。镉浓度通过电感耦合等离子体质谱法测定。
1.5 菌株细胞形态与代谢活性 1.5.1 菌株细胞表型特征将离心后的样品用2.5%戊二醛固定10 h,0.05 mol/L磷酸盐缓冲液冲洗4次。用酒精逐级脱水,每次0.5 h。乙酸异戊酯置换2次,每次0.5 h。临界点干燥并喷金处理。在Quanta FEG 250扫描电子显微镜下观察细胞表型特征。
1.5.2 降解酶活性检测邻苯二酚1, 2-双加氧酶活性的检测参考卫昆等[22]和曾光明等[23]报道的方法,提取的粗酶液采用Agilent Cary 60紫外可见分光光度计在波长260 nm处分析酶反应产物产生量。定义每分钟1 μmol底物转化所需的酶量为1个酶活力单位U。
1.5.3 电子传递系统活性检测微生物的电子传递体系活性测定参考尹军等[24]和Gu等[25]的方法,通过提供过量的电子供体(NADH与琥珀酸),以人工添加的碘硝基氯化四氮唑蓝(iodonitrotetrazolium chloride, INT)为电子受体,测定微生物将INT还原为甲臜(iodonitrotetrazolium chloride formazan, INTF)的速率来指示微生物的电子传递体系活性。
1.6 数据统计和分析各批次实验均设置平行实验组(n=3)。数据处理以及图形绘制使用Excel 2019和OriginPro 2018c进行,使用MEGA 7.0软件进行菌株系统进化发育树构建。
2 结果与分析 2.1 PAHs降解菌的分离与鉴定纯化分离得到1株PAHs降解菌株,编号SZ-3。该菌落呈圆形,为白色偏浅黄色,菌落边缘整齐,菌体较小,表面有光泽(图 1A);长度为1.5−2.0 μm,宽度为0.3−0.5 μm,无芽孢,无鞭毛,扫描电镜观察呈杆状(图 1B)。SZ-3菌株不能发酵葡萄糖、蔗糖、果糖和乳糖;革兰氏染色为阳性;吲哚反应为阴性;过氧化氢实验和脲酶实验均为阳性。将菌株测序结果(GenBank登录号:OL780824)与数据库中已知核酸序列进行相似性比较,结果显示SZ-3与节杆菌属序列相似性达100%。利用MEGA 7.0软件及其邻接法(neighbor-joining)构建系统进化发育树(图 1C)。综合上述结果,初步鉴定SZ-3属于Arthrobacter,命名为Arthrobacter sp. SZ-3。
|
| 图 1 分离菌株SZ-3形态和系统进化发育树 Figure 1 Morphology and phylogenetic tree of SZ-3. A: Colony morphology. B: Microscopic bacterial morphology (10 000×). C: Phylogenetic tree of SZ-3 based on 16S rRNA gene sequence. Node number represents the confidence level of relatives. The length of branch represents the evolutionary distance. Ruler represents 0.1% of sequence evolutionary differences. |
2.2 菌株对镉的抗性和耐受性
抗性用于表征微生物抵抗重金属胁迫的能力,耐受性可表征微生物适应胁迫的能力。如表 1所示,菌株B6-2和SZ-3的最低抑制浓度存在的区间分别为1 000 mg/L < MIC < 1 200 mg/L、100 mg/L < MIC < 200 mg/L,B6-2的镉抗性高于SZ-3,表明镉对B6-2细胞的毒性影响相对更小。2株菌对镉的抗性特征存在明显差异,当体系中镉胁迫浓度低于100 mg/L时,株菌细胞的生理生化特性优良。
| Bacterial strains | Cd(Ⅱ) (mg/L) | MICs (mg/L) | |||||||
| 0 | 50 | 100 | 200 | 400 | 800 | 1 000 | 1 200 | ||
| B6-2 | + | + | + | + | + | + | + | − | 1 000 < MIC < 1 200 |
| SZ-3 | + | + | + | − | − | − | − | − | 100 < MIC < 200 |
| +: The ability to grow; −: Inhibition of growth. | |||||||||
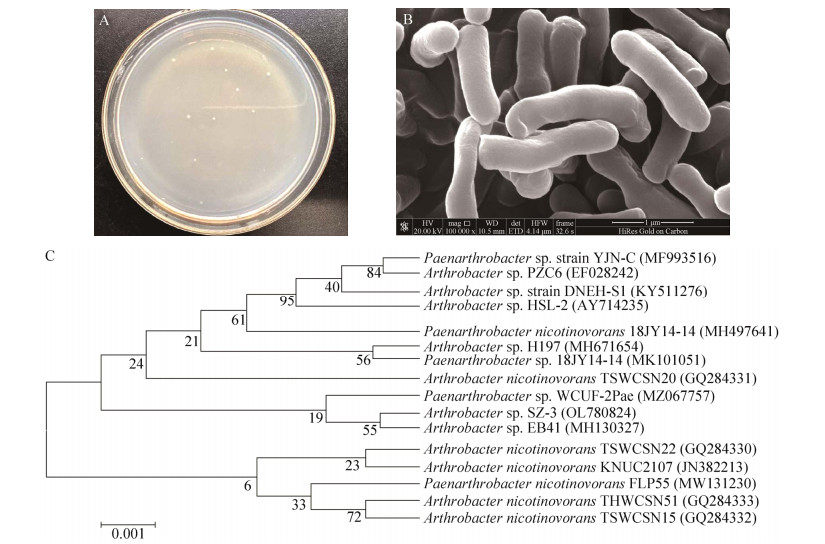
图 2为2菌株对镉的耐受性表征结果。相较于无镉添加的对照组(CK),2株菌的细胞生长均受到镉胁迫的影响并出现延迟生长的现象。随着初始镉浓度的增加,微生物生长曲线的停滞适应期时长随之增加,可能是摄入细胞内的镉或被吸附于细胞表面的镉对细胞正常代谢产生抑制效应[26]。镉胁迫浓度大于0.5 mg/L时,B6-2细胞生长的停滞适应期较SZ-3更短。在10 mg/L镉胁迫下B6-2、SZ-3生长停滞适应期约为5、6 h;50 mg/L镉胁迫下B6-2、SZ-3生长停滞适应期约为15、20 h。随着镉初始浓度的增加,B6-2和SZ-3细胞生长停滞适应期的差异也越大。Kuppusamy等[27]对PAHs和HMs长期污染土壤中细菌群落特征分析结果表明,污染场地中革兰氏阴性菌总体数量较革兰氏阳性菌占优,微生物群落中革兰氏阳性菌重金属抗性和耐受性总体低于革兰氏阴性菌,这与本文研究结果一致。
|
| 图 2 菌株在不同浓度镉赋存时的生长曲线 Figure 2 Growth curves of two strains at different concentrations of cadmium. A: B6-2. B: SZ-3. |
2.3 菌株协同的菲和镉去除特性 2.3.1 单菌和混菌体系的镉胁迫效应分析
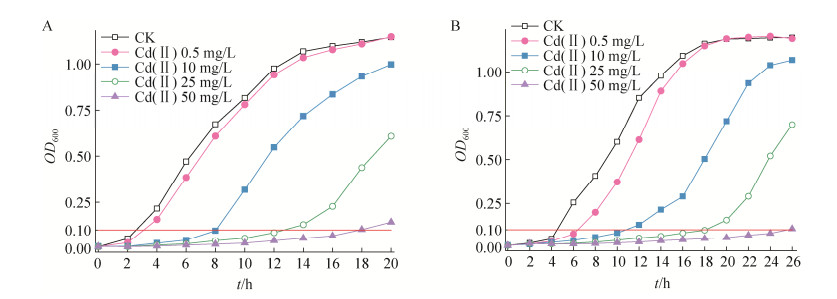
图 3A显示了B6-2、SZ-3和M这3种降解体系在不同浓度镉胁迫下第10天的菲降解率。当镉浓度为0−0.5 mg/L时SZ-3对菲降解效率显著(P < 0.05)高于B6-2。当镉胁迫浓度从10 mg/L增加至50 mg/L时,SZ-3菲降解率从57.99%下降至21.76%,而B6-2对菲的降解效率从62.64%降低至53.39%。当镉的浓度为10 mg/L时,相较于SZ-3菲降解能力的急剧下降,混菌M受镉胁迫效应的冲击影响甚微,周期结束混菌对菲的去除率较对照组(84.81%)仅下降3.62%。当体系中镉的浓度为50 mg/L时,3组反应体系对菲的降解效果为M (64.90%) > B6-2 (53.39%) > SZ-3 (21.76%)。多菌株协同受镉胁迫影响较小,即使在高浓度镉赋存时混菌M仍具备良好的菲降解能力。
|
| 图 3 功能菌在不同条件下的菲降解效率 Figure 3 Efficiency of phenanthrene degradation by bacteria under different conditions. A: Degradation rate of phenanthrene on day 10 under different cadmium concentrations by different bacteria. B: Degradation efficiency of phenanthrene by M under different cadmium concentration. Error bars in figure represent standard deviation. |
2.3.2 菌株协同对菲的去除特性
不同镉浓度胁迫下降解菌对菲的去除特性如图 3B所示。随着镉初始浓度的增加,反应初期菌株协同体系各实验组菲的降解速率呈降低趋势。反应周期结束时,初始镉浓度为0.5 mg/L实验组菲降解率(83.02%)与对照组(84.81%)相当,低浓度镉赋存对菲的生物降解影响不显著(P > 0.05);反应第一天时,微量镉的存在略微促进了菲的去除,这可能是菌体细胞对菲的吸附导致。由于菌体细胞呈负电性,具有吸引金属阳离子的倾向和潜势,菌体表面的负电荷逐渐被中和而转变为中性状态,增强了微生物对多环芳烃的吸附能力,可在一定程度上提高微生物对菲的去除效率[28-29]。镉浓度为10 mg/L时,相较于对照组,菲降解率仅降低3.62%。高浓度(25、50 mg/L)镉胁迫体系中第10天菲降解效率与对照组相比分别降低16.5%、23.01%。在反应周期结束时,高浓度镉胁迫下菲降解率仍有上升的趋势,结合图 4D中OD600值变化分析可知,第10天时微生物的生长尚未达到稳定期,菲降解率仍有提高空间。
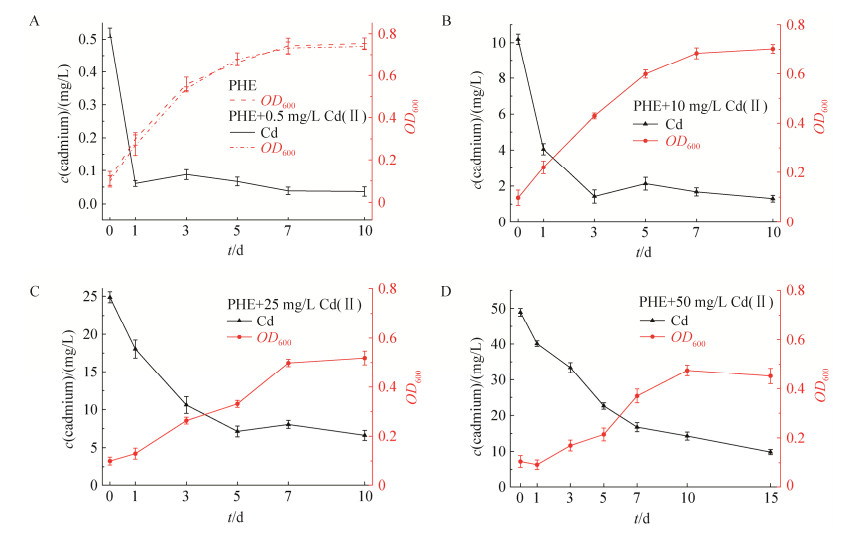
|
| 图 4 混菌M生物量变化和镉残留浓度 Figure 4 OD600 value and cadmium residual concentration of M under different cadmium concentrations. A: 0. B: 10 mg/L. C: 25 mg/L. D: 50 mg/L. Error bars represent standard deviation. |
2.3.3 菌株协同对镉的去除特性
图 4为不同镉胁迫浓度下混菌体系M的菌株生长及反应周期内的镉去除特性。镉初始浓度为0.5、10、25和50 mg/L时,反应周期结束时剩余镉浓度分别为0.031、1.294、6.615和14.811 mg/L,相应的镉最高去除率分别为92.88%、87.06%、73.54%和71.47%。菌株协同对镉的去除效能随初始镉浓度的增加而降低。结合体系中OD600值的变化分析可知,镉初始浓度为0.5、10 mg/L的实验组,体系中镉最大去除量在细菌对数生长期实现;而对于较高浓度(25、50 mg/L)的实验体系,则在细菌衰亡期达到镉最大去除量。反应周期内,不同初始镉浓度胁迫条件下镉去除过程特性呈现一定差异。
2.4 菌株协同的细胞形态及酶活特征对镉赋存浓度的响应特性 2.4.1 镉胁迫对细胞表型特征的影响图 5为不同浓度镉胁迫下混菌M形态的扫描电子显微镜结果图。对照组细胞形态完整,菌体饱满,表面清晰光滑。10 mg/L镉胁迫对细胞表型影响不明显。随着胁迫浓度进一步增加,菌体细胞表型特征的变化随之显著。大量菌体表面变得粗糙伴有褶皱产生,出现菌体缩小、由杆状断裂或收缩成球状的现象。此外,在高浓度(25、50 mg/L)实验组可以观察到菌体间的黏附性和聚集性随着镉胁迫浓度的增加逐步提高,细菌可能分泌了胞外聚合物,这些胞外聚合物的分泌可能是菌株耐受多种重金属的机制之一[30]。

|
| 图 5 不同镉浓度胁迫下混菌M的扫描电镜图 Figure 5 Scanning electron microscope (50 000×) of M under different cadmium concentrations. A: 0. B: 10 mg/L. C: 25 mg/L. D: 50 mg/L. |
2.4.2 镉胁迫对关键降解酶活性的影响
邻苯二酚是多环芳烃生物降解中重要的中间产物,根据开环方式的不同,可分为邻位降解途径和间位降解途径。其中邻位降解途径中的关键酶是邻苯二酚1, 2-双加氧酶(catechol 1, 2-dioxygenase, C120),邻苯二酚经双加氧酶催化后进入三羧酸循环进而降解为二氧化碳和水[31]。如图 6A所示,随着镉胁迫浓度的增加,周期内同一取样时间点的各实验组C120的活性总体呈降低趋势,表明镉胁迫对降解酶活性存在抑制作用。镉初始浓度为0、0.5和10 mg/L时,反应周期内邻苯二酚1, 2-双加氧酶活性呈现先增加后降低的趋势,第5天时各组酶活性均达到最大值。0.5 mg/L镉胁迫浓度的反应组第5天酶活性(84.16 U/mL)较对照组酶活性(80.71 U/mL)略高,之后这2组的酶活性趋近一致。结合2.3.3剩余镉浓度分析可知,初期低浓度镉的存在抑制了C120的活性,随着体系中镉浓度的降低,酶活性逐渐恢复并达到与对照组相近水平。镉对邻苯二酚1, 2-双加氧酶活性存在抑制作用,在镉浓度为10−50 mg/L范围内,胁迫浓度越高,对降解酶活性的抑制作用越强,50 mg/L的抑制作用最显著(P < 0.05)。曾光明等[23]的研究认为镉对降解菌的产酶过程及酶促降解过程均有抑制作用,这与本文研究结果一致。
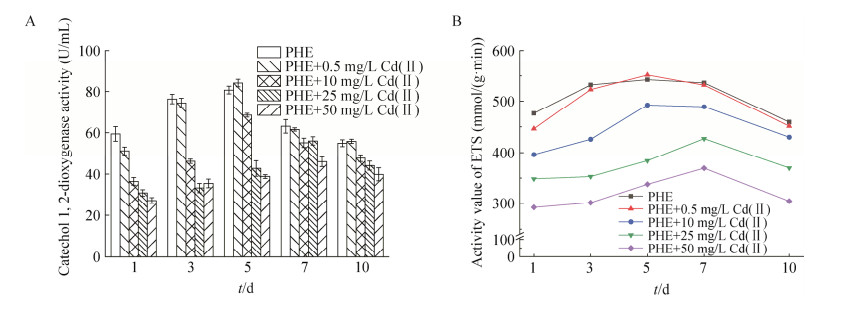
|
| 图 6 镉对混菌细胞活性影响 Figure 6 Changes of cadmium on cell activity in the synergistic removal process. A: Catechol 1, 2-dioxygenase activity. B: Electron transport system activity. Error bars represent standard deviation. |
2.4.3 镉胁迫对电子传递体系活性影响
微生物的电子传递体系(electron transport system, ETS)活性是普遍采用的微生物活性评价方法之一[32]。由图 6B可以看出,镉初始浓度10−50 mg/L范围内,镉对电子传递体系活性的抑制作用均较为显著(P < 0.05)。对照组与不同浓度镉胁迫的实验组的ETS活性均呈现先升高后降低的趋势。尽管ETS活性随时间的变化趋势基本相同,但同一时间点各组间ETS活性值具有较大差异。对照组和0.5 mg/L镉胁迫的实验组ETS活性的变化过程出现96 h的稳定期(3−7 d);10 mg/L镉胁迫的体系中ETS活性逐渐升高并在第5天达到最高值,并保持约48 h的稳定后开始降低;而25、50 mg/L镉胁迫的实验组ETS活性约在第7天达到最高值,随后即快速降低。
3 讨论迄今已报道百余种降解菌可通过好氧代谢实现PAHs的完全矿化,菌株降解效能及其对重金属的抗性特征是复合污染微生物修复的关键。本课题组从钢铁厂周边污染土壤中分离出一株多环芳烃高效降解菌SZ-3,经生理生化检测和16S rRNA基因同源性分析鉴定该菌属于节杆菌属细菌。
在重金属胁迫的多环芳烃降解体系中,降解菌的抗性和耐受性是其确保微生物细胞正常生理生化性能的基本前提[20]。本研究采用PAHs生物降解效能良好,对镉抗性耐受性存在差异的SZ-3和B6-2两株菌进行混菌协同修复菲-镉污染特性研究。其中,B6-2的镉抗性高于SZ-3。B6-2最小抑制浓度为1 000−1 200 mg/L,高于Xu等[33]和解琳等[34]从土壤中分离出的Pseudomonas sp.和Beauveria bassiana。2株菌镉耐受性表征显示,在高浓度镉(25、50 mg/L)约束条件下,B6-2耐受性优于SZ-3。有研究认为细菌的重金属抗性机制与新陈代谢活动有关,主要包括渗透性屏障排斥、胞外吸附与胞内积累、外排泵的主动运输、酶的解毒等[35-36]。革兰氏阴性菌B6-2与革兰氏阳性菌SZ-3之间结构与组成的差异可能会影响微生物本身对重金属的抗性及耐受性。
菲生物降解效能随着镉初始胁迫浓度的增加而降低,相较于单菌株实验体系,混菌协同在一定程度上缓解了菲降解过程的镉胁迫的不利影响。当镉初始浓度为50 mg/L时,反应周期内混菌体系对菲的降解率较SZ-3和B6-2提高了43.14%、11.51%。混菌体系已被证实可以减轻单个底盘细胞的代谢负担、降低中间代谢物的过度积累和毒害,并对复杂环境介质具有更强的适应性和鲁棒性[37-38],这些优势都会提高混菌体系降解效能。根据实验结果,0.5 mg/L镉赋存对混菌降解菲的影响不显著(P > 0.05),镉初始浓度为10 mg/L时,反应周期结束时混菌体系对菲的降解率为81.19%。有研究表明[11],10 mg/L铬共存体系中Pseudomonas brassicacearum LZ-4能够降解77%的萘。Shi等[39]发现受5 mg/L镉影响,P. aeruginosa对十溴二苯醚的降解率约为30%。在50 mg/L的镉作为单一污染物体系中,伯克霍尔德氏菌[40]和芽孢杆菌属[41]的去除率分别为38%和46.93%。本研究中多菌株协同体系在30 mg/L菲与50 mg/L镉共存情况下,反应周期末镉和菲的去除率分别为71.47%、64.9%,高于上述文献报道。因此,菌株B6-2与SZ-3协同高效修复菲-镉复合污染的优势突出。另一方面,不同浓度镉赋存条件下周期内镉去除效率随着时间的变化与细胞生长周期特征也存在差异。这可能是由于镉对微生物细胞具有毒害作用[42],以及细胞解毒抗胁迫的生理行为对不同浓度镉赋存的响应不同导致。
微生物对HMs的去除主要依靠细胞表面吸附和胞内积累实现,微生物比表面积大、细胞膜表面及胞外聚合物中含有羧基、膦酸盐和羟基等官能团,均可以通过吸附和络合等作用减少体系中重金属含量或将重金属转化为低毒或者无毒的状态[6]。扫描电镜结果显示,镉胁迫浓度的提高导致菌体表型特性随之改变,即菌株在受到镉胁迫后会通过改变自身形态来响应环境的变化。推断重金属胁迫可能会影响菌体形态建成相关基因的表达模式。同时,由于胞外聚合物的分泌,菌体间黏附性和聚集性提高。胞外聚合物能够促进重金属吸附在细胞表面[43],并与重金属形成螯合物,进一步实现重金属的去除。
细菌对菲的好氧降解一般是从双加氧酶催化的加氧反应开始,双加氧酶在菲的生物降解过程中起重要作用。电子传递体系活性体现了微生物呼吸活性,间接指示降解菌的代谢活性变化。降解酶活性与电子传递体系活性的研究结果表明,镉对邻苯二酚1, 2-双加氧酶活性存在抑制作用,在镉浓度10−50 mg/L范围内,抑制作用均十分显著(P < 0.05)。这与曾光明[23]等的研究结果一致。电子传递体系活性呈现与邻苯二酚1, 2-双加氧酶活性较为一致的规律,低浓度镉胁迫对混菌M降解菲过程中电子传递体系活性影响不明显(P > 0.05),而更高镉胁迫浓度抑制明显(P < 0.05)。陈皓[32]等发现,活性污泥的电子传递体系活性随镉浓度增加而明显降低。Li等[44]指出沉积物中微生物在多环芳烃降解过程中电子传递体系活性受到锰的抑制降低31%−70%。因此,初步推断降低菲降解酶活性和电子传递体系活性是镉影响多菌株协同降解菲的重要机制之一。
4 结论(1) 随着环境污染特征的日益复杂,难降解有机物-重金属复合污染问题的关注度增加,复合污染的微生物修复技术的深度研发对菌株资源的挖掘提出更高要求。从复合污染土壤中筛选出一株高效降解菌,经鉴定SZ-3属于节杆菌属细菌。该菌不仅具备多环芳烃降解能力,而且对重金属镉具备一定抗性和耐受性。
(2) 将重金属抗性较高的Pseudomonas putida B6-2与菲降解能力强的Arthrobacter sp. SZ-3构建的混菌协同体系M具有复合污染修复的生态位协同互补效应,能够确保较高浓度镉胁迫下良好的菲生物降解效能,丰富了环境污染微生物治理的菌株资源,可为微生物修复重金属-多环芳烃复合污染提供参考。
(3) 低浓度(≤0.5 mg/L)镉赋存几乎不影响混菌M的菲降解能力,但镉浓度持续提高会降低菲和镉的去除效能。结果显示,M在30 mg/L菲和10 mg/L镉复合污染中培养10 d,能够去除81.19%菲与87.06%镉。
(4) 在菲的降解过程中,镉对降解菌细胞的生理毒害表现为改变生物细胞的表面性质,通过抑制邻苯二酚1, 2-双加氧酶的活性,进而降低功能菌电子传递体系活性,影响微生物的代谢,与协同体系的降解特性规律一致。
致谢
本实验中Pseudomonas putida B6-2由上海交通大学生命科学技术学院食品与环境微生物技术实验室提供,在此表示感谢。
| [1] | QIN YF, LIU YQ, WANG JB, LU Y, XU ZM. Emission of PAHs, PCBs, PBDEs and heavy metals in air, water and soil around a waste plastic recycling factory in an industrial park, Eastern China. Chemosphere, 2022, 294: 133734. DOI:10.1016/j.chemosphere.2022.133734 |
| [2] |
WANG YF, HE LS, JIANG DL, CAO Y, LI Q, GONG J. Distribution and ecological risk assessment of polycyclic aromatic hydrocarbons and heavy metals in coking sites in China. Environmental Science, 2021, 42(12): 5938-5948.
(in Chinese) 王耀锋, 何连生, 姜登岭, 曹莹, 李强, 宫健. 我国焦化场地多环芳烃和重金属分布情况及生态风险评价. 环境科学, 2021, 42(12): 5938-5948. DOI:10.13227/j.hjkx.202105239 |
| [3] | PREMNATH N, MOHANRASU K, GURU RAJ RAO R, DINESH GH, PRAKASH GS, ANANTHI V, PONNUCHAMY K, MUTHUSAMY G, ARUN A. A crucial review on polycyclic aromatic Hydrocarbons- Environmental occurrence and strategies for microbial degradation. Chemosphere, 2021, 280: 130608. DOI:10.1016/j.chemosphere.2021.130608 |
| [4] | YOUSEFI M, SHESHADI G, KHORSHIDIAN N, GHASEMZADEH-MOHAMMADI V, FAKHRI Y, HOSSEINI H, MOUSAVI KHANEGHAH A. Polycyclic aromatic hydrocarbons (PAHs) content of edible vegetable oils in Iran: a risk assessment study. Food and Chemical Toxicology, 2018, 118: 480-489. DOI:10.1016/j.fct.2018.05.063 |
| [5] | CAO XF, CUI XW, XIE M, ZHAO R, XU L, NI SQ, CUI ZJ. Amendments and bioaugmentation enhanced phytoremediation and micro-ecology for PAHs and heavy metals co-contaminated soils. Journal of Hazardous Materials, 2022, 426: 128096. DOI:10.1016/j.jhazmat.2021.128096 |
| [6] | LIU SH, ZENG GM, NIU QY, LIU Y, ZHOU L, JAING LH, TAN XF, XU P, ZHANG C, CHENG M. Bioremediation mechanisms of combined pollution of PAHs and heavy metals by bacteria and fungi: a mini review. Bioresource Technology, 2017, 224: 25-33. DOI:10.1016/j.biortech.2016.11.095 |
| [7] |
ZENG J, WU YC, LIN XG. Advances in microbial remediation of soils polluted by polycyclic aromatic hydrocarbons. Acta Microbiologica Sinica, 2020, 60(12): 2804-2815.
(in Chinese) 曾军, 吴宇澄, 林先贵. 多环芳烃污染土壤微生物修复研究进展. 微生物学报, 2020, 60(12): 2804-2815. DOI:10.13343/j.cnki.wsxb.20190511 |
| [8] | WANAPAISAN P, LAOTHAMTEEP N, VEJARANO F, CHAKRABORTY J, SHINTANI M, MUANGCHINDA C, MORITA T, SUZUKI-MINAKUCHI C, INOUE K, NOJIRI H, PINYAKONG O. Synergistic degradation of pyrene by five culturable bacteria in a mangrove sediment-derived bacterial consortium. Journal of Hazardous Materials, 2018, 342: 561-570. DOI:10.1016/j.jhazmat.2017.08.062 |
| [9] | JIA XQ, HE Y, JIANG DW, LIU C, LU WY. Construction and analysis of an engineered Escherichia coli-Pseudomonas aeruginosa co-culture consortium for phenanthrene bioremoval. Biochemical Engineering Journal, 2019, 148: 214-223. DOI:10.1016/j.bej.2019.05.010 |
| [10] | MARTINEZ I, MOHAMED MES, ROZAS D, GARCIA JL, DIAZ E. Engineering synthetic bacterial consortia for enhanced desulfurization and revalorization of oil sulfur compounds. Metabolic Engineering, 2016, 35: 46-54. DOI:10.1016/j.ymben.2016.01.005 |
| [11] | HUANG HY, WU KJ, KHAN A, JIANG YM, LING ZM, LIU P, CHEN Y, TAO XY, LI XK. A novel Pseudomonas gessardii strain LZ-E simultaneously degrades naphthalene and reduces hexavalent chromium. Bioresource Technology, 2016, 207: 370-378. DOI:10.1016/j.biortech.2016.02.015 |
| [12] | HONG JW, PARK JY, GADD GM. Pyrene degradation and copper and zinc uptake by Fusarium solani and Hypocrea lixii isolated from petrol station soil. Journal of Applied Microbiology, 2010, 108(6): 2030-2040. |
| [13] | LIU J, ZHANG AN, LIU YJ, LIU Z, LIU Y, WU XJ. Analysis of the mechanism for enhanced pyrene biodegradation based on the interactions between iron-ions and Rhodococcus ruber strain L9. Ecotoxicology and Environmental Safety, 2021, 225: 112789. DOI:10.1016/j.ecoenv.2021.112789 |
| [14] | TIWARY M, DUBEY AK. Cypermethrin bioremediation in presence of heavy metals by a novel heavy metal tolerant strain, Bacillus sp. AKD1. International Biodeterioration & Biodegradation, 2016, 108: 42-47. |
| [15] | LIU SH, ZENG GM, NIU QY, GONG JL, HU XJ, LU LH, ZHOU YY, HU X, CHEN M, YAN M. Effect of Pb(ii) on phenanthrene degradation by new isolated Bacillus sp. P1. RSC Advances, 2015, 5(69): 55812-55818. DOI:10.1039/C5RA04867B |
| [16] | MA YN, ZHAO YY, WANG YF, LI XZ, SUN FF, CORVINI PFX, JI R. Effects of Cu2+ and humic acids on degradation and fate of TBBPA in pure culture of Pseudomonas sp. strain CDT. Journal of Environmental Sciences, 2017, 62: 60-67. DOI:10.1016/j.jes.2017.07.012 |
| [17] | XIA X, WU SJ, ZHOU ZJ, WANG GJ. Microbial Cd(II) and Cr(VI) resistance mechanisms and application in bioremediation. Journal of Hazardous Materials, 2021, 401: 123685. DOI:10.1016/j.jhazmat.2020.123685 |
| [18] | WANG WW, LI QG, ZHANG LG, CUI J, YU H, WANG XY, OUYANG XY, TAO F, XU P, TANG HZ. Genetic mapping of highly versatile and solvent-tolerant Pseudomonas putida B6-2 (ATCC BAA-2545) as a 'superstar' for mineralization of PAHs and dioxin-like compounds. Environmental Microbiology, 2021, 23(8): 4309-4325. DOI:10.1111/1462-2920.15613 |
| [19] | TANG HZ, YU H, LI QG, WANG XY, GAI ZH, YIN GB, SU F, TAO F, MA CQ, XU P. Genome sequence of Pseudomonas putida strain B6-2, a superdegrader of polycyclic aromatic hydrocarbons and dioxin-like compounds. Journal of Bacteriology, 2011, 193(23): 6789-6790. DOI:10.1128/JB.06201-11 |
| [20] | BRAUNER A, FRIDMAN O, GEFEN O, BALABAN NQ. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nature Reviews Microbiology, 2016, 14(5): 320-330. DOI:10.1038/nrmicro.2016.34 |
| [21] | CHEN XM, ZHAO Y, ZHAO XY, WU JQ, ZHU LJ, ZHANG X, WEI ZM, LIU Y, HE PP. Selective pressures of heavy metals on microbial community determine microbial functional roles during composting: Sensitive, resistant and actor. Journal of Hazardous Materials, 2020, 398: 122858. DOI:10.1016/j.jhazmat.2020.122858 |
| [22] |
WEI K, CHEN SN, YIN H, YE JS, PENG H, LIU ZH. The biodegradation characteristics of Pyrene Bacillus cereus and its enzyme. Acta Scientiae Circumstantiae, 2016, 36(2): 506-512.
(in Chinese) 卫昆, 陈烁娜, 尹华, 叶锦韶, 彭辉, 刘则华. 蜡状芽胞杆菌对芘的降解特性及降解酶研究. 环境科学学报, 2016, 36(2): 506-512. DOI:10.13671/j.hjkxxb.2015.0435 |
| [23] |
ZENG GM, LIU SH, NIU QY, LIU YG, HU XJ. Effects of Cd(Ⅱ) on enzyme productions of PAHs-biodegrading Bacillus sp. P1 and the characteristics of enzymatic degradation. Journal of Hunan University: Natural Sciences, 2014, 41(12): 109-114.
(in Chinese) 曾光明, 刘少恒, 牛秋雅, 刘云国, 胡新将. Cd(Ⅱ)对多环芳烃降解菌Bacillus sp. P1产酶及酶促降解过程影响研究. 湖南大学学报(自然科学版), 2014, 41(12): 109-114. |
| [24] |
YIN J, TAN XJ, REN NQ. Evaluation of TTC and INT-electron transport system activity tests for heavy metal inhibition of activated sludge. Environmental Science, 2005, 26(1): 56-62.
(in Chinese) 尹军, 谭学军, 任南琪. 用TTC与INT-电子传递体系活性表征重金属对污泥活性的影响. 环境科学, 2005, 26(1): 56-62. DOI:10.13227/j.hjkx.2005.01.013 |
| [25] | GU X, LENG JT, ZHU JT, ZHANG K, ZHAO JQ, WU P, XING QY, TANG KJ, LI XL, HU B. Influence mechanism of C/N ratio on heterotrophic nitrification- aerobic denitrification process. Bioresource Technology, 2022, 343: 126116. DOI:10.1016/j.biortech.2021.126116 |
| [26] | WU C, LI F, YI SW, GE F. Genetically engineered microbial remediation of soils co-contaminated by heavy metals and polycyclic aromatic hydrocarbons: advances and ecological risk assessment. Journal of Environmental Management, 2021, 296: 113185. DOI:10.1016/j.jenvman.2021.113185 |
| [27] | KUPPUSAMY S, THAVAMANI P, MEGHARAJ M, VENKATESWARLU K, LEE YB, NAIDU R. Pyrosequencing analysis of bacterial diversity in soils contaminated long-term with PAHs and heavy metals: implications to bioremediation. Journal of Hazardous Materials, 2016, 317: 169-179. DOI:10.1016/j.jhazmat.2016.05.066 |
| [28] | WANG JL, CHEN C. Biosorbents for heavy metals removal and their future. Biotechnology Advances, 2009, 27(2): 195-226. DOI:10.1016/j.biotechadv.2008.11.002 |
| [29] | LI ZH, LIU JL, QIAO MH, FAN KN. A theoretical study on the metal cation-π complexes of Zn2+ and Cd2+ with benzene and cyclohexene. Molecular Physics, 2009, 107(8/9/10/11/12): 1271-1282. |
| [30] | LEMIRE JA, HARRISON JJ, TURNER RJ. Antimicrobial activity of metals: mechanisms, molecular targets and applications. Nature Reviews Microbiology, 2013, 11(6): 371-384. DOI:10.1038/nrmicro3028 |
| [31] | HARITASH AK, KAUSHIK CP. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): a review. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15. |
| [32] |
CHEN H, CHEN L, ZHAO JF, HUANG AQ. Effects of heavy metallic ions on electron transport system activity of anaerobic sludge. Environmental Science, 2007, 28(4): 4786-4790.
(in Chinese) 陈皓, 陈玲, 赵建夫, 黄爱群. 重金属对厌氧污泥电子传递体系活性影响研究. 环境科学, 2007, 28(4): 4786-4790. |
| [33] | XU SZ, XING YH, LIU S, HAO XL, CHEN WL, HUANG QY. Characterization of Cd2+ biosorption by Pseudomonas sp. strain 375, a novel biosorbent isolated from soil polluted with heavy metals in Southern China. Chemosphere, 2020, 240: 124893. DOI:10.1016/j.chemosphere.2019.124893 |
| [34] |
XIE L, HAO Y, QI X, LIU BS, WEN YC, LIU LJ, YANG XJ, JIN ZM. Isolation, identification and biosorption characteristics of a lead and cadmium resistant fungus. Acta Microbiologica Sinica, 2020, 60(4): 780-788.
(in Chinese) 解琳, 郝宇, 齐欣, 刘本松, 温昱晨, 刘丽杰, 杨晓杰, 金忠民. 一株耐铅镉真菌的分离鉴定及其吸附特性的研究. 微生物学报, 2020, 60(4): 780-788. |
| [35] | KONG WT, MELDGIN DR, COLLINS JJ, LU T. Designing microbial consortia with defined social interactions. Nature Chemical Biology, 2018, 14(8): 821-829. DOI:10.1038/s41589-018-0091-7 |
| [36] | WEN ZQ, LEDESMA-AMARO R, LU MR, JIANG Y, GAO SL, JIN MJ, YANG S. Combined evolutionary engineering and genetic manipulation improve low pH tolerance and butanol production in a synthetic microbial Clostridium community. Biotechnology and Bioengineering, 2020, 117(7): 2008-2022. DOI:10.1002/bit.27333 |
| [37] |
LI HC, DING MZ. Advances in biodegradation of petroleum hydrocarbons. Chinese Journal of Biotechnology, 2021, 37(8): 2765-2778.
(in Chinese) 李恒昌, 丁明珠. 石油烃生物降解过程的研究进展. 生物工程学报, 2021, 37(8): 2765-2778. |
| [38] | LIU Y, DING MZ, LING W, YANG Y, ZHOU X, LI BZ, CHEN T, NIE Y, WANG MX, ZENG BX, LI X, LIU H, SUN BD, XU HM, ZHANG JM, JIAO Y, HOU YN, YANG H, XIAO SJ, LIN QC, et al. A three-species microbial consortium for power generation. Energy & Environmental Science, 2017, 10(7): 1600-1609. |
| [39] | SHI GY, YIN H, YE JS, PENG H, LI J, LUO CL. Effect of cadmium ion on biodegradation of decabromodiphenyl ether (BDE-209) by Pseudomonas aeruginosa. Journal of Hazardous Materials, 2013, 263: 711-717. |
| [40] |
LI ZY, CAO MM, ZHOU DB, WANG W, QI CL, XIE JH. Adsorption characteristics and mechanism of high cadmium-tolerant bacteria Burkholderia sp. DF3-1 to cadmium. Chinese Journal of Tropical Crops, 2022, 43(3): 589-596.
(in Chinese) 李卓阳, 曹苗苗, 周登博, 王尉, 戚春林, 谢江辉. 高耐镉细菌Burkholderia sp. DF3-1对镉的吸附特性及机理. 热带作物学报, 2022, 43(3): 589-596. |
| [41] | SAHU S, RAJBONSHI MP, GUJRE N, GUPTA MK, SHELKE RG, GHOSE A, RANGAN L, PAKSHIRAJAN K, MITRA S. Bacterial strains found in the soils of a municipal solid waste dumping site facilitated phosphate solubilization along with cadmium remediation. Chemosphere, 2022, 287: 132320. |
| [42] | BRUINS MR, KAPIL S, OEHME FW. Microbial resistance to metals in the environment. Ecotoxicology and Environmental Safety, 2000, 45(3): 198-207. |
| [43] | MEJIAS CARPIO IE, ANSARI A, RODRIGUES DF. Relationship of biodiversity with heavy metal tolerance and sorption capacity: a meta-analysis approach. Environmental Science & Technology, 2018, 52(1): 184-194. |
| [44] | LI CH, YE C, WONG YS, TAM NFY. Effect of Mn(IV) on the biodegradation of polycyclic aromatic hydrocarbons under low-oxygen condition in mangrove sediment slurry. Journal of Hazardous Materials, 2011, 190(1/2/3): 786-793. |
 2023, Vol. 63
2023, Vol. 63