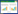中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 李仪, 刘化金, 李祥, 吕欣孺, 柴洪亮. 2022
- Yi LI, Huajin LIU, Xiang LI, Xinru LV, Hongliang CHAI. 2022
- H5N8亚型高致病性禽流感病毒的全球流行概况
- Global epidemiology of H5N8 subtype highly pathogenic avian influenza virus
- 微生物学报, 62(1): 10-23
- Acta Microbiologica Sinica, 62(1): 10-23
-
文章历史
- 收稿日期:2021-04-23
- 修回日期:2021-07-22
- 网络出版日期:2021-11-04
2. 黑龙江兴凯湖国家级自然保护区管理局, 黑龙江 密山 158300
2. Khanka Lake National Nature Reserve of Heilongjiang, Mishan 158300, Heilongjiang, China
禽流感(avian influenza,AI)是一种高度传染性疾病,鸟类活动是其在全球范围传播的重要因素。禽流感病毒(avian influenza virus,AIV)能感染家禽、野鸟和哺乳动物甚至人类。根据其致病力大小可分为高致病性禽流感(highly pathogenic avian influenza,HPAI)和低致病性禽流感(low pathogenic avian influenza,LPAI),其中HPAI在家禽中造成高死亡率,被世界动物卫生组织列为A类疫病,被我国列为一类传染病。截至目前,HPAI均由H5或H7血凝素(hemagglutinin,HA)亚型病毒引起。
自1996年在中国广东首次分离到H5N1亚型HPAIV (A/goose/Guangdong/1/1996)以来,根据H5基因的进化分析发现,病毒已进化出10个分支(0–9)和许多亚分支以及次亚分支[1],并已传播至亚洲、欧洲、北美洲及非洲,感染了家禽、野鸟以及哺乳动物(包括人类)。家禽、野鸟的H5N1亚型AIV不断发生重组与突变,产生不同亚型的H5Nx病毒,包括N2、N3、N5、N6、N8和N9[2-3]。
2008年WHO、OIE、FAO对H5N1的H5基因制定分类标准,将核苷酸差异 < 1.5%的定义为一个分支(clade)[1],2015年对H5命名系统进行更新,新增2.3.4.4分支以替换临时使用的2.3.4.6分支[4],并将该分支细分为group A–D。H5N8亚型HPAIV主要集中在2.3.4.4分支的group A和B。2019年末,为了确切描述2.3.4.4分支H5基因的遗传进化规律,H5的命名系统再次修订,将2.3.4.4分支的H5基因分为8个分支2.3.4.4 a–h[5],而H5N8亚型HPAIV主要集中在2.3.4.4 b分支。这种编号系统客观地反映了H5之间的谱系关系,消除地理名称,例如:2005年“福建系”现归为2.3.4的三级谱系,2005年“青海系”划归为2.2的二级谱系。
2010年2.3.4分支的H5N8亚型HPAIV首次在中国家禽中发现,但没有引发大规模疫情。2014年,韩国的家禽以及野鸟暴发了多起H5N8亚型HPAI疫情,随后,中国、日本以及欧洲、北美各国亦有发生,进而引发第一波洲际流行。到2016年,H5N8亚型HPAI传播至欧洲、中东以及非洲等国家和地区,导致第二波全球H5N8亚型HPAI疫情的出现。现阶段,第三波全球H5N8亚型HPAI正在世界范围内流行,大量野生鸟类及家禽死亡,造成极大的经济损失。2020年12月,首次出现H5N8亚型HPAIV感染人的事件,H5N8亚型HPAIV现已成为威胁全球的重要生物安全问题之一。
1 全球H5N8亚型HPAI流行趋势 1.1 首次发现H5N8亚型HPAIV2010年,在中国江苏活禽市场的家禽中首次分离到2.3.4分支的H5N8亚型HPAIV (A/duck/Jiangsu/k1203/2010[H5N8])[6-8],此次发现的病毒虽未引发家禽疫情以及人感染病例,但动物感染实验证明,病毒在小鼠中表现出的毒力呈中到高等,并可能对流感药物有耐药性。2013年,在中国浙江省家禽中分离到2株由A/duck/Jiangsu/k1203/2010 (H5N8)、A/environment/ Jiangxi/28/2009 (H11N9)、A/duck/Hunan/8-19/2009 (H4N2)等毒株重组而来的H5N8亚型HPAIV (W24、6D18),动物感染实验表明,这2株病毒对家鸡具有高致病性,对小鼠不易感[8],表明其对于哺乳动物(包括人类)的感染能力有限。同年,中国上海首次监测到野鸟源H5N8亚型HPAIV[9],与浙江W24、6D18同属于2.3.4.4分支的group B。2014年,从上海的大杓鹬(Numenius madagascariensis)分离到7株H5N8亚型HPAIV,与2014年韩国、欧洲、北美流行的H5N8毒株同属于group A。
1.2 H5N8亚型HPAI第一波洲际流行(2014–2015年) 1.2.1 亚洲疫情:2014年1月16日,韩国全罗北道一水库附近的养鸭场的家鸭出现了产蛋量下降、死亡率上升等典型HPAIV感染症状,并在次日向OIE报告此波疫情。1月17日,距离水库5 km的一个养殖场也报告了家鸭出现流感典型症状[10]。对此次疫情代表毒株分析发现,其与2010年中国江苏家禽源H5N8亚型HPAIV以及中国上海野鸟源毒株高度同源。通过对H5基因进行遗传进化分析发现,其属于2.3.4.6分支(此分支在2015年被重新修订为2.3.4.4),并将毒株Buan2以及Gochang1分别作为H5N8亚型AIV在2.3.4.4分支group A和B的代表株。尽管韩国采取了严格的疫情防控管理措施,然而直到一年后的2015年1月,疫情仍未得到有效控制,影响了韩国369家养殖场,其中73%是家鸭养殖场,与此同时,也从野鸟中监测到H5N8亚型HPAIV[11]。据统计,自疫情开始,截至2015年7月6日,韩国已有782个农场的近1 900万只家禽被扑杀。随后此波疫情逐渐蔓延至中国、日本等周边国家以及欧洲、北美各国。
2014年2月到4月,中国开始出现疫情:浙江、江苏、山东的家禽及上海野鸟中均分离到毒株,其中江苏、山东鹅源H5N8亚型HPAIV的相关实验表明,其能结合α-2, 3唾液酸受体和α-2, 6唾液酸受体[12],表明病毒对养殖业以及公共卫生安全具有潜在威胁。
同年4月,日本九州岛养鸡场出现H5N8亚型HPAI疫情,其中熊本县扑杀超11.2万只鸡,严格的防控措施起到了一定效果,在2014年11月候鸟到达日本越冬之前,此波疫情没有进一步暴发。然而当12月野鸟迁徙进入日本境内,日本开始大面积暴发家禽H5N8亚型HPAI疫情,2014年12月发生3起家禽疫情,紧接着2015年1月又发生2起,这几起疫情均发生在养鸡场[13]。同时从鸳鸯(Aix galericulata)、小天鹅(Cygnus columbianus)、白枕鹤(Grus vipio)等野生禽类的粪便和环境中也监测到了H5N8亚型HPAIV[14]。通过对在日本疫情中分离到的毒株A/chicken/Kumamoto/1-7/2014 (Kum14)基因分析表明,所有基因片段与2014年韩国疫情家禽源分离株Buan14高度同源(> 99.59%)[15]。
2014年9月,疫情不断向西蔓延,在中国浙江的家禽和环境样本以及俄罗斯东北部赤颈鸭(Anas penelope)中发现了H5N8亚型HPAIV。
2015年1月到2月,中国台湾的86个鸡场、44个鸭场和636个鹅场出现了H5亚型HPAI疫情,扑杀大约150万只鸡、20万只鸭和220万只鹅,后经检测发现此次疫情由H5N2、H5N3、H5N8亚型HPAIV共同导致,其中H5N8亚型与日本、北美H5N8亚型HPAIV有直接的共同祖先,都属于2.3.4.4分支的group A[16-18]。
1.2.2 欧洲疫情:2014年11月3日,德国东北部一家火鸡养殖场16周龄的育肥火鸡突然大量死亡,后经研究发现,这是由H5N8亚型HPAIV引起的疫情,由此H5N8亚型HPAIV开始进入欧洲并引发流行。发生疫情的养殖场位于一湿地附近,周围有大量野鸟出没,但该地区家禽密度低,四周被森林、农田包围,出入受限,相对隔离。养殖场的6个鸡舍中,靠近养殖场入口的鸡舍首先出现火鸡死亡,相邻鸡舍相继出现大量死亡的情况。流行病学调查排除了以下导致疫情发生的原因:(1) 火鸡蛋或雏禽带毒;(2) 受污染的水、饲料或垃圾传播病毒;(3) 在韩国等东亚地区被病毒污染的物品或人员导致病毒传播等[18]。而17日德国吕根岛的绿翅鸭(Anas crecca)拭子样本呈H5N8亚型HPAIV阳性更加证实了这一点:病毒来源可能为常出没在附近湿地携带有AIV的野鸟,它们导致垃圾、饲料、水等污染,促使病毒传播至养殖场,最终导致火鸡感染。根据获得基因的遗传进化及系统发育分析发现:这些毒株与同年来自日本的H5N8亚型HPAIV相似。
2014年11月9日,荷兰一个拥有6个鸡舍、12.4万只家禽的养鸡场,其中1个鸡舍的鸡死亡数量呈指数型增长[19]。自此次荷兰养鸡场暴发H5N8亚型HPAI疫情之后[20],H5N8疫情便在欧洲盛行:英国、意大利等国相继出现多起疫情。荷兰于2015年4月29日宣布这波疫情的结束,2016年全年未出现H5N8疫情报道,直到2017年再次出现。通过对荷兰疫情毒株的分析发现,此次疫情可能由与在西伯利亚的亚洲候鸟有重叠的迁徙路线或共同的繁殖区的迁徙候鸟带来。英国在11月18日报告:约克郡一个养鸭场暴发H5N8亚型HPAI。意大利于12月15报告了H5N8亚型HPAI疫情,导致火鸡养殖场3万余只火鸡死亡或被扑杀。这几起疫情毒株均与荷兰疫情毒株高度同源。
2015年,匈牙利、瑞典等欧洲国家首次出现H5N8亚型HPAI疫情,该波疫情在欧洲地区持续至2015年年中,造成严重经济损失。
1.2.3 北美疫情:2014年12月,在美国华盛顿的猎鹰等野鸟以及家禽中发现了与2.3.4.4分支Buan2-like相近的H5N8亚型HPAIV,这是北美地区首次发现H5N8亚型HPAIV,经分析发现:病毒可能在2014年春天由迁移候鸟携带至西伯利亚和白令海峡地区,并在繁殖季节不断重组、进化,随后在秋季随着鸟类迁徙路线传入北美[21]。这些病毒作为基因供体,重组出之后在北美流行的H5N2。北美地区的加拿大也于2015年首次出现H5N8亚型HPAI疫情。
1.3 H5N8亚型HPAI第二波洲际流行(2016–2019年) 1.3.1 亚洲疫情:2016年5月和6月,在中国青海湖和俄罗斯乌布苏湖的斑头雁(Anser indicus)、苍鹭(Ardea cinerea)、普通鸬鹚(Phalacrocorax carbo)等死亡野鸟中分离到2.3.4.4分支group B的H5N8亚型HPAIV,从此开启了第二波H5N8亚型HPAI全球疫情[22-24]:2016年秋冬至2017年,H5N8亚型HPAIV在欧洲、非洲、亚洲的多个国家被分离到,并作为基因供体不断重组,产生随后在欧洲流行的H5N5亚型AIV。对青海湖及乌布苏湖疫情流行病学调查发现:青海湖在4月就存在这些病毒,其中HA、NA和NS基因与2014年中国东部的H5N8同源性较高,PB1、PB2、PA、NP和M基因与蒙古、中国和越南发现的LPAIV同源性较高,推测其可能由起源于孟加拉湾越冬地的迁徙候鸟,在2016年春季沿中亚迁徙路线向北扩散并不断重组,导致H5N8亚型HPAIV引入中国青海湖地区,当候鸟继续北迁,导致病毒传播到乌布苏湖和西伯利亚等候鸟繁殖地。在疫区环境水样中发现的与死亡野鸟相同的毒株,进一步证明了栖息地的水环境可能对野鸟之间的病毒传播起到了重要作用,推断野鸟可能通过环境感染病毒并传播。这波疫情跨越亚洲、欧洲和非洲。
2016年10月,印度两家动物园的水禽暴发H5N8亚型HPAI,此次动物园水禽疫情暴发的时间正好是中亚迁徙路线的候鸟秋季迁徙到达印度的时间[24]。印度是2016年继中国青海湖和俄罗斯乌布苏湖暴发疫情后最早发生H5N8亚型HPAI疫情的国家。对HA基因的系统发育分析表明,这些分离株与欧亚地区的H5N8亚型HPAIV聚集在2.3.4.4分支group B,并与中国青海湖及俄罗斯乌布苏湖H5N8密切有关。NS基因的42S突变和PB1基因的13P突变表明病毒对小鼠的毒力有所增加。
2016年11月,伊朗德黑兰省一蛋鸡养殖场发生H5N8亚型HPAI疫情,造成4 455只蛋鸡死亡,这是伊朗首次发现H5N8亚型HPAIV。HA基因的遗传和系统发育分析表明,伊朗H5N8亚型HPAIV属于2.3.4.4分支的group B,与2016年年中在俄罗斯发现的H5N8基因序列相似性极高。溯源研究发现,病毒可能通过从俄罗斯和东南亚返回的候鸟传入伊朗,再由候鸟向养殖场传播[25]。通过对2017年在伊朗冠鸦(Platylophus galericulatus)体内分离到的H5N8亚型HPAIV遗传进化分析发现:其PA、NS、PB1、PB2和M与韩国2016年和2017年H5N8毒株的遗传关系非常密切,NP基因与欧洲谱系H5N8毒株具有较高的相似性,与伊朗家禽源H5N8高度同源,这一追溯性研究更加支持了伊朗养殖场暴发的疫情是由候鸟迁徙带来并传播给家禽的这一观点。这株H5N8存在PB1基因的P598L、PB2基因的E627K等突变情况[26],会导致病毒与α-2, 6唾液酸受体的亲和力增加,对哺乳动物具有潜在威胁。
2017年12月19日,沙特阿拉伯一家活禽市场发现各种禽类大量死亡,截至2018年5月,在沙特多省监测的7 273只禽类中805例呈H5N8阳性,其中利雅得报告了693例,是最严重的省份,受到影响的养殖场包括22个蛋鸡养殖场、2个肉鸡养殖场和1个鹌鹑养殖场[27]。HA基因的系统发育分析显示,它们均属于2.3.4.4分支group B。PA、HA、NP、NA、M和NS片段与来自不同地区的野生候鸟的H5N8病毒相似,PB1和PB2片段与在俄罗斯远东地区和欧洲分离到的由H5N8重组而来的H5N5亚型HPAIV关系密切。2018至2019年间,中东地区(以色列、伊朗、伊拉克和科威特)以及巴基斯坦不断有H5N8疫情暴发的报道。
1.3.2 欧洲疫情:2016年10月,这波疫情在欧洲开始出现。10月19日,匈牙利报道了第一起野鸟源H5N8亚型HPAI疫情,11月1日在家禽中暴发,随后疫情蔓延至欧洲多个国家。欧洲的这波疫情可分为2个阶段:第一阶段始于2016年11月,一直持续到年底。克罗地亚、瑞士、德国、奥地利、荷兰、丹麦、法国等国从11月开始相继暴发疫情,其中,较为严重的德国、荷兰、丹麦、法国均是先在野鸟中发现病毒,随后在家禽中暴发。而疫情同样严重的瑞士只是在野鸟中暴发疫情,并在一周内迅速传播,从东北(康斯坦斯湖)和西南(日内瓦湖)迅速蔓延至瑞士中部高原,但大规模养殖场以及家庭散养家禽未发生疫情[28],这可能与当地严格的防控措施有关。在这一阶段中,法国不仅发生80余起H5N8亚型HPAI疫情,还发生了136起与H5N8亚型HPAIV密切相关的H5Nx亚型HPAI疫情,80%的H5N8疫情发生在水禽养殖场(主要是养鸭场)[29]。第二阶段从2017年2月开始,野鸟及家禽感染数量显著增加,特别是法国、德国、波兰、罗马尼亚的疫情暴发次数均超过百起,整个欧洲暴发次数超1 300起;影响范围更广,几乎遍布整个欧洲,并不断向非洲蔓延。
1.3.3 非洲疫情:2016年冬季,非洲地区开始出现H5N8亚型HPAI疫情。首先在离欧洲较近的埃及地区的迁徙野鸟中分离到2.3.4.4分支group B的H5N8。随后,埃及多省又报告数起家禽H5N8亚型HPAI疫情。多株埃及H5N8亚型HPAIV的NS1基因含S42,可增加AIV在哺乳动物中的毒力;HA基因存在T156A的突变,该突变能使病毒经呼吸道感染雪貂;PB2基因中存在的V667I突变,能够增强病毒致病性以及向人类传播的能力。小鼠实验表明,埃及这些毒株对小鼠具有感染性。而这些毒株对于埃及目前使用的H5疫苗并不敏感,这将增加大面积发生疫情的风险[30]。
在2016年12月,在乌干达中南部维多利亚湖沿岸出现大规模的鸥类死亡,随后出现家禽死亡现象[31]。2017年4月底,刚果伊图里省位于鲁文佐里山脉和乌干达之间的阿尔伯特湖亦发生家禽和野鸟大量死亡的情况[32]。后经研究发现,这两起疫情均为2.3.4.4分支group B的H5N8亚型HPAIV引起,并与2016年中国青海湖、俄罗斯乌布苏湖的毒株有密切关系。
2017年6月初,非洲南部的津巴布韦报告一起养殖场疫情。6月19日,南非出现H5N8亚型HPAI疫情:第一起疫情发生在南非一肉鸡养殖场,随后在家庭散养禽类、鸵鸟、企鹅等众多家禽及野鸟中发现该病毒。南非是此次疫情发生最严重的非洲国家,到2017年11月,南非9个省中只有2省未受疫情影响[33]。进一步调查显示,导致该国发生疫情的H5N8亚型HPAIV属于2.3.4.4分支group B,与同年来自西非的尼日尔、尼日利亚、喀麦隆等国H5N8亚型HPAIV有共同的祖先。在这波疫情中,非洲暴发的H5N8亚型HPAI疫情均与同年欧洲疫情及2016年中国青海湖和俄罗斯乌布苏湖疫情有密切关系。
2018年南非全年暴发H5N8亚型HPAI疫情60余次,仅次于发生81次疫情的俄罗斯。自2019年开始,H5N8亚型HPAI疫情在非洲的流行范围更加广泛。2019年1月,非洲纳米比亚哈利法克斯岛的非洲企鹅突然大量死亡,对样本进行分析发现为H5N8亚型HPAIV导致,这也是纳米比亚境内首次发现H5N8亚型HPAIV[34],对HA和NA基因的序列分析证实该病毒与2017年在南非发现的H5N8亚型HPAIV高度同源,随后尼日利亚、南非、埃及等非洲国家不断出现疫情。
1.4 H5N8亚型HPAI第三波洲际流行(2020年)2019年12月31日,波兰暴发由2.3.4.4 b的H5N8亚型HPAIV引起的禽流感疫情[35],随后,罗马尼亚、斯洛伐克、捷克、保加利亚、德国、匈牙利、以色列等欧洲国家及伊拉克、伊朗、沙特等中东国家的野鸟和家禽在2020年上半年相继暴发H5N8亚型HPAI疫情,引起这些疫情的毒株与2016–2019年流行毒株核苷酸一致性较低,但具有相同的进化来源:主要由非洲地区2.3.4.4分支group B的H5N8亚型HPAIV和欧亚谱系的LPAIV发生重组而来。
2020年,非洲地区仅有南非出现疫情,其疫情原因为本国上次疫情的延续,与2020年新一波疫情关联不大。
俄罗斯于2020年7月底开始出现疫情。2020年下半年,亚洲的韩国、日本也出现疫情。韩国自2018年4月以来,长期对野鸟和家禽进行大规模的主动监测,均未监测到H5N8亚型HPAIV毒株,但2020年10月,在野鸟禽流感主动监测中,从一只鸳鸯的粪便中分离出一株属于2.3.4.4分支group B的H5N8亚型HPAIV (A/Mandarin duck/Korea/K20-551-4/2020 [H5N8])[36]。在遗传进化分析中,K20-551-4的所有8个基因片段与2016–2018年在韩国流行的同属于2.3.4.4分支group B的H5N8毒株遗传距离较远,但与2020年初在欧洲家禽和野鸟中检测到的2.3.4.4分支group B的H5N8毒株关系密切。同期,日本在迁徙候鸟的粪便样中分离到2.3.4.4 b分支的H5N8亚型HPAIV (A/northern pintail/Hokkaido/M13/2020 [H5N8])[37],序列分析结果表明,M13与2017–2018年冬季东亚地区毒株遗传关系较远,与2019冬季到2020年欧洲毒株的序列高度同源,推测M13是通过鸟类迁徙从欧洲传入,而不是本土2.3.4.4 b分支的H5亚型HPAIV毒株重组的产物。综合这两起疫情来看,此波疫情中的亚洲毒株主要还是由于野鸟活动从欧洲引入。
时隔两年,我国再次出现H5N8亚型HPAI疫情:2020年10月,内蒙古自治区巴彦淖尔的乌梁素海湖发生野生天鹅H5N8亚型HPAI疫情[38];2020年11月,山西运城市平陆县三湾大天鹅景区发生野生天鹅H5N8亚型HPAI疫情,该区域栖息野生天鹅4 000余只,发病2只、死亡2只[39];2021年1月山东省东营市黄河三角洲自然保护区大汶流管理站发生野生天鹅H5N8亚型HPAI疫情,疫点栖息野生禽类249只,发病35只、死亡35只[40];2021年2月北京市海淀区圆明园遗址公园发生野生天鹅H5N8亚型HPAI疫情,疫点栖息野生禽类15只,发病3只、死亡3只[41];2021年2月5日,江苏省连云港市云台山景区发生野禽H5N8亚型HPAI疫情,疫点栖息野生禽类约647只,发病17只、死亡17只[42]。病毒溯源工作还在进行中。
1.5 全球H5N8亚型HPAI流行趋势小结从2010年发现第一例H5N8亚型HPAIV开始,至今已引发三波洲际疫情,受影响大洲包括欧洲、亚洲、非洲以及北美洲(图 1)。
|
| 图 1 H5N8亚型HPAIV流行情况 Figure 1 The epidemic situation of the H5N8 subtype HPAIV. |
第一波疫情始于2014年韩国,受疫情影响的国家包括中国、日本和北美、欧洲各国等:2014年1月在韩国家禽和野生禽类中发现H5N8亚型HPAIV,并确定了2.3.4.4分支group A和B的H5N8亚型AIV代表株。对2014年这波疫情中所获基因片段的遗传分析表明:欧洲家禽和野生禽类H5N8亚型HPAIV的基因组与亚洲韩国和日本的家禽和野生禽类H5N8亚型HPAIV的基因组非常相似。欧洲(德国、意大利、荷兰和英国)、俄罗斯远东地区、北美(美国、加拿大)、日本、中国台湾、中国上海以及部分韩国的毒株之间有密切的遗传关系,同属于group A。
第二波疫情始于2016年4–6月中国青海湖和俄罗斯乌布苏湖,相较2014年的疫情,2016年这波疫情受影响范围更广,持续时间更长:受影响地区包括亚洲、欧洲、非洲等地区国家,多数国家均为首次出现H5N8亚型HPAI疫情。这波疫情的前期主要集中在欧洲,后期向非洲蔓延,造成严重的经济损失。在此期间,奥地利、比利时、波黑、保加利亚、克罗地亚、捷克、丹麦、芬兰、法国、德国、希腊、匈牙利、爱尔兰、意大利、立陶宛、卢森堡、马其顿、荷兰、波兰、葡萄牙、罗马尼亚、俄罗斯、塞尔维亚、斯洛伐克、斯洛文尼亚、西班牙、瑞典、瑞士、英国和乌克兰共计30个欧洲国家报告了家禽、野鸟的H5N8亚型HPAI疫情。在这30个国家中,有19个国家首先在野鸟中检测到H5N8亚型HPAIV,6个国家首先在家禽中检测到,5个国家几乎同一时期在野鸟和家禽中检测到H5N8亚型HPAIV,法国、德国和匈牙利是受疫情影响最严重的几个欧洲国家。非洲疫情主要由野鸟的持续迁徙从欧洲带至非洲,而欧洲疫情由2016年中国青海湖和俄罗斯乌布苏湖疫情扩散导致。
这波疫情后期(2018–2019年)主要集中在中东、非洲以及俄罗斯等地区,欧洲地区仅有瑞典、意大利以及位于东南欧的保加利亚,除中东地区以外的亚洲地区仅巴基斯坦出现疫情。2018年发生疫情的国家和地区数量较2017年下降了近60%。2018至2019年中国、日本、韩国、东南亚以及北美洲、南美洲均未报告家禽或野鸟发生H5N8亚型HPAI疫情,2016–2019年疫情毒株同属2.3.4.4分支group B,推测2018至2019年疫情为2016年疫情的延续。
第三波疫情始于2019年年底至2020年年初的欧洲,至今还未结束,截至目前已导致欧洲、亚洲多国野鸟及家禽的死亡事件,并在我国引发多起野生鸟类H5N8亚型HPAI疫情,这波疫情均由2.3.4.4 b分支的H5N8引起。
2020年前,全球对2.3.4.4分支的H5主要采用group A–D的分支方式,其中H5N8主要集中在group A和B。Group A分支以A/broiler duck/Korea/Buan2/2014为代表,主要包括2014年早期中国毒株以及2014–2015年源于韩国并传播至中国台湾、日本、欧洲、北美等地区流行的H5N8毒株;group B分支以A/breeder duck/Korea/Gochang1/2014为代表,主要包括2013年中国南方、2016年疫情至今在全球流行的大部分毒株。Group B流行范围更广,影响程度更大。通过对H5N8亚型HPAIV的遗传进化分析发现:group A已由2.3.4.4 c替代,group B已由2.3.4.4 b替代(图 2)。由于主动监测力度不足以及各国之间防控政策的差异,导致禽流感数据空白较多,对于H5N8的溯源工作相对较难,至今仍不清楚2010年H5N8亚型HPAIV的来源。
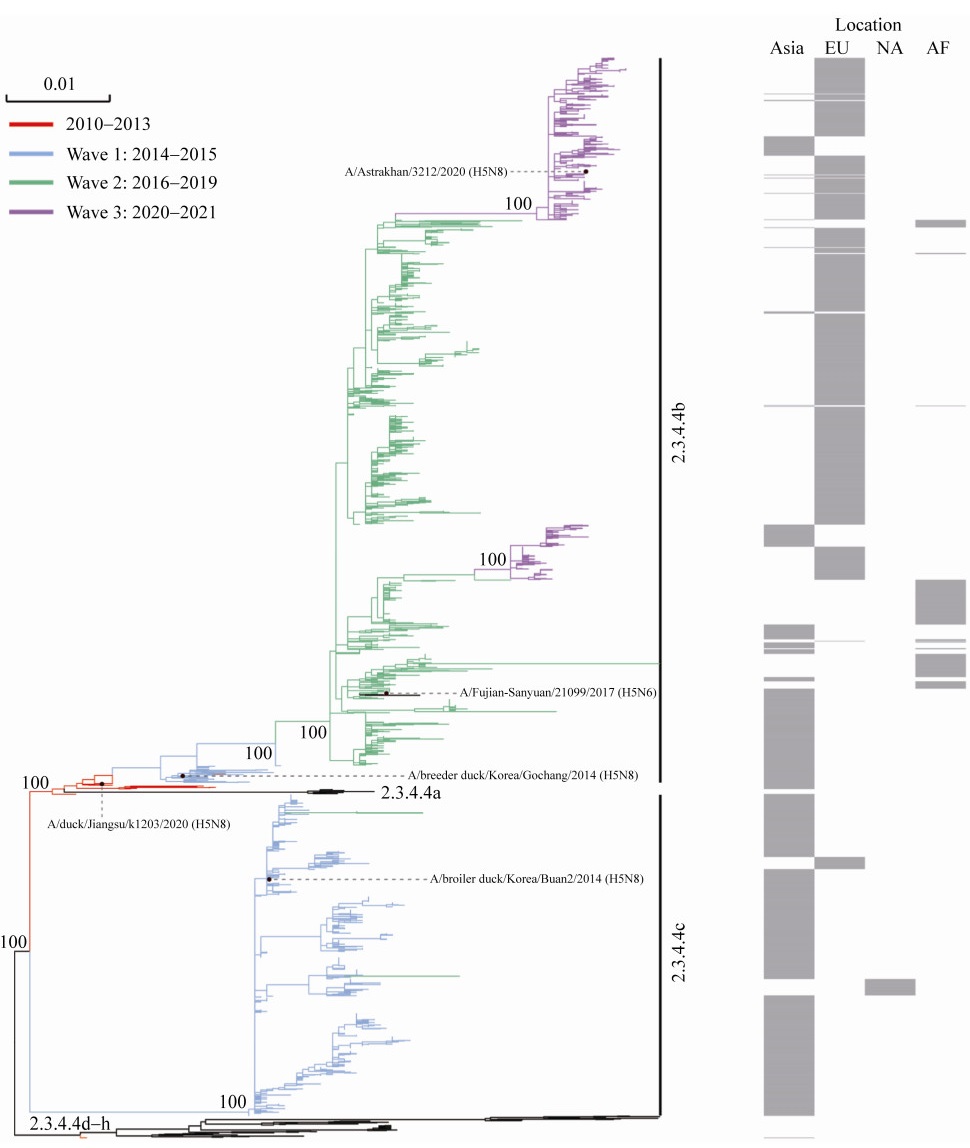
|
| 图 2 H5N8亚型HPAIV遗传进化树 Figure 2 Maximum-likelihood phylogenetic tree of HA gene of the H5N8 subtype HPAIV. Sequences were downloaded from NCBI and GISAID. The representative strains of 2.3.4.4a–h were selected as WHO recommended (https://apps.who.int/iris/bitstream/handle/10665/336259/WER9544-525-539-eng-fre.pdf?sequence=1&isAllowed=y). Different periods of the H5N8 subtype HPAIV are colored in different colors. Other H5 subtype strains are colored in black. EU: Europe; NA: North America; AF: Africa. |
2 野鸟对H5N8亚型HPAIV传播的影响
到目前为止,H5N8亚型HPAIV已从亚洲、欧洲、非洲、北美洲等的多个国家和地区的多种野鸟中分离出来,宿主包括雁鸭类、鸻鹬类、鹤类、鹰隼类。据统计,25%的家禽疫情暴发点在12.1 km范围内有野鸟暴发疫情,50%在21.3 km范围内有野鸟疫情发生,80%在33 km范围内有野鸟疫情发生[43],这一现象表明,野鸟与家禽发生疫情存在关联。回顾2014年开始的三波全球H5N8亚型HPAI疫情,大多数国家首先在野鸟中发现病毒,之后在家禽中暴发,且三波疫情均由迁徙候鸟携带并传播,导致野鸟及家禽的感染。每年全球大量的迁徙候鸟从分布在欧洲、亚洲、非洲、美洲等地区的越冬地沿着各自的迁徙通道迁徙到西伯利亚地区进行繁殖,之后又会沿着各自的路线迁徙到达越冬地。相互重叠的迁徙通道、直接或间接与病鸟或污染环境接触,导致候鸟间携带的AIV相互传播、重组,这促进了病毒的全球传播。
我国位于东亚-澳大利亚、中亚-印度、西亚-中非的重要迁徙通道上,特别是2020年以来,韩国、日本等邻国不断有H5N8亚型HPAI暴发的报道,2020年10月内蒙古自治区巴彦淖尔、2020年11月山西运城、2021年1月山东东营、2021年2月北京海淀区及江苏连云港等多地发生野生禽类H5N8亚型HPAI疫情。我们应警惕暴发大规模疫情,加强对野生鸟类特别是迁徙候鸟的禽流感主动监测,早发现、早预警。
3 H5N8亚型HPAIV具有重要的公共卫生意义2014年韩国疫情期间,一只饲养在发生疫情养殖场的犬被检测到抗体,利用H5N8亚型HPAIV进行犬感染实验时,部分犬只出现体温升高的情况,但并未在其体内分离到病毒或者检测到抗体[44]。有实验证明,H5N8部分位点的突变会使其适应雪貂,从而导致雪貂感染[45],并且不断有发现例如:PB1基因的P598L、PB2基因的K627E、HA基因的T156A等能导致病毒对哺乳动物毒力增强的突变。波兰分别在2016年11月和2017年4月,从两只灰海豹肺部样本中检测到2.3.4.4分支group B的H5N8亚型HPAIV[46],与当时欧洲禽流感疫情暴发期间在野鸟中流行的H5N8亚型HPAIV同源性为99.7%–100%。两只海豹相隔5个月被感染,推测可能由野鸟的种间传播导致,但也不能排除灰海豹种内传播的可能。有研究发现,同属2.3.4.4分支group B的H5N6亚型HPAIV是由H5N8亚型AIV发生重组产生[47-48],例如:2017年我国福建发生的人感染2.3.4.4分支group B的H5N6亚型HPAIV,是由2016年湖北黑天鹅H5N8亚型AIV与野鸟源H6N6亚型LPAIV重组产生,并在家禽中不断传播进化,最终由家禽传播给人类。
随着病毒的不断重组突变,跨物种传播能力逐渐显现。2020年12月,在俄罗斯南部一个暴发H5N8亚型HPAI疫情的养殖场中,首次发现人感染H5N8亚型HPAIV。7名被感染者为29至60岁的养殖场工人,被感染者尽管均为无症状感染,未发现人传人现象,但能确定的是H5N8亚型HPAIV已经具备了感染人的能力,不排除将来对人的毒力增强的可能。此次H5N8主要由家禽传染给人,并不具备人传人的能力。我们需对H5N8保持高度警惕,重视H5N8亚型HPAIV的公共卫生意义。
4 关于禽流感防控的建议作为禽流感病毒的天然储存库,野生鸟类在禽流感病毒防控中的地位不容小觑:从来自多个国家的野生鸟类中检测到同源性极高的AIV,并通过进化分析论证,支持了AIV的全球传播是由迁徙候鸟驱动的这一理论,“野鸟→家禽→野鸟→家禽”的传播链促进病毒不断重组进化。对于野生鸟类,应加强主动监测,禁止非法贸易;发现野外死鸟应及时向相关部门报告。
作为重要的经济和食物来源,家禽的禽流感防控也应格外注意:(1) 严格限制和控制与家禽的接触:限制访客的数量和车辆,并让其尽可能远离禽舍,在进入养殖场时,应穿上清洁的工作服和鞋子,以避免将病毒带到养殖场;(2) 建立有效的野鸟及虫鼠防治制度:通过诱饵诱捕来监测野鸟、害虫及老鼠的活动,饲料仓库和饲喂槽必须定期清洁、维护和适当密封,以防止野鸟、鼠类等进入并污染饲料;(3) 避免将疾病状态不明的野鸟引入禽群:在养殖场周围设立围栏,不要在养殖场内存放可能吸引野鸟的物品,包括放置的家禽饲料产品等;(4) 在适当的情况下为家禽接种疫苗;(5) 若出现异常死亡情况,应向兽医部门报告,并在指导下采取正确措施,妥善处置粪便、垃圾及死禽,同时进行积极监测。
人类感染禽流感的主要风险因素是接触被感染的活禽、死禽或受污染的环境,如活禽市场;在家庭环境中,处理家禽生肉制品也是危险因素之一。个人应遵守良好的食品卫生安全以及手部卫生规范。应尽量避免前往已知暴发禽流感疫情的地区或国家,如需前往,应避免前往农场、活禽市场、动物屠宰场等与禽类密切接触的地方,避免接触任何疑似被动物粪便污染的表面。目前,还没有预防人类禽流感感染的疫苗,若住在或曾去过禽流感暴发的地区,并出现类似流感的症状,如发烧、咳嗽和呼吸困难,应立即就医,并说明相关情况。
| [1] | WHO/OIE/FAO H5N1 Evdution Working Group. Toward a unified nomenclature system for highly pathogenic avian influenza virus (H5N1). Emerging Infectious Diseases, 2008, 14(7): e1. DOI:10.3201/eid1407.071681 |
| [2] | De Vries E, Guo HB, Dai ML, Rottier PJM, Van Kuppeveld FJM, De Haan CAM. Rapid emergence of highly pathogenic avian influenza subtypes from a subtype H5N1 hemagglutinin variant. Emerging Infectious Diseases, 2015, 21(5): 842-846. DOI:10.3201/eid2105.141927 |
| [3] | Yu Y, Wang XB, Jin T, Wang HL, Si WY, Yang H, Wu JS, Yan Y, Liu G, Sang XY, Wu XP, Gao YW, Xia XZ, Yu XF, Pan JC, Gao GF, Zhou JY. Newly emergent highly pathogenic H5N9 subtype avian influenza A virus. Journal of Virology, 2015, 89(17): 8806-8815. DOI:10.1128/JVI.00653-15 |
| [4] | Evolution of the influenza A (H5) haemagglutinin. WHO/OIE/FAO H5 Working Group reports a new clade designated 2.3.4.4. [Internet]. Available at: https://www.who.int/influenza/gisrs_laboratory/h5_nomenclature_clade2344/en/. Accessed year 2017. |
| [5] | WHO. Antigenic and genetic characteristics of zoonotic influenza A viruses and development of candidate vaccine viruses for pandemic preparedness. [Internet]. Available at: https://www.who.int/influenza/vaccines/virus/201909_zoonotic_vaccinevirusupdate.pdf?ua=1. Accessed year 2019. |
| [6] | Sun HL, Pu J, Hu J, Liu LT, Xu GL, Gao GF, Liu XF, Liu JH. Characterization of clade 2.3.4.4 highly pathogenic H5 avian influenza viruses in ducks and chickens. Veterinary Microbiology, 2016, 182: 116-122. DOI:10.1016/j.vetmic.2015.11.001 |
| [7] | Zhao KK, Gu M, Zhong L, Duan ZQ, Zhang Y, Zhu YM, Zhao G, Zhao MJ, Chen ZY, Hu SL, Liu WB, Liu XW, Peng DX, Liu XF. Characterization of three H5N5 and one H5N8 highly pathogenic avian influenza viruses in China. Veterinary Microbiology, 2013, 163(3/4): 351-357. |
| [8] | Wu HB, Peng XR, Xu LH, Jin CZ, Cheng LF, Lu XY, Xie TS, Yao HP, Wu NP. Novel reassortant influenza A (H5N8) viruses in domestic ducks, Eastern China. Emerging Infectious Diseases, 2014, 20(8): 1315-1318. |
| [9] | Zhou LC, Liu J, Pei EL, Xue WJ, Lyu JM, Cai YT, Wu D, Wu W, Liu YY, Jin HY, Gao YW, Wang ZH, Wang TH. Novel avian influenza A (H5N8) viruses in migratory birds, China, 2013-2014. Emerging Infectious Diseases, 2016, 22(6): 1121-1123. DOI:10.3201/eid2206.151754 |
| [10] | Lee YJ, Kang HM, Lee EK, Song BM, Jeong J, Kwon YK, Kim HR, Lee KJ, Hong MS, Jang I, Choi KS, Kim JY, Lee HJ, Kang MS, Jeong OM, Baek JH, Joo YS, Park YH, Lee HS. Novel reassortant influenza A (H5N8) viruses, south Korea, 2014. Emerging Infectious Diseases, 2014, 20(6): 1086-1089. DOI:10.3201/eid2006.140233 |
| [11] | Yoon H, Moon OK, Jeong W, Choi J, Kang YM, Ahn HY, Kim JH, Yoo DS, Kwon YJ, Chang WS, Kim MS, Kim DS, Kim YS, Joo YS. H5N8 highly pathogenic avian influenza in the republic of Korea: epidemiology during the first wave, from January through July 2014. Osong Public Health and Research Perspectives, 2015, 6(2): 106-111. DOI:10.1016/j.phrp.2015.01.005 |
| [12] | Li J, Gu M, Liu D, Liu BQ, Jiang KJ, Zhong L, Liu KT, Sun WQ, Hu J, Wang XQ, Hu SL, Liu XW, Liu XF. Phylogenetic and biological characterization of three K1203(H5N8)-like avian influenza A virus reassortants in China in 2014. Archives of Virology, 2016, 161(2): 289-302. DOI:10.1007/s00705-015-2661-2 |
| [13] | Saito T, Tanikawa T, Uchida Y, Takemae N, Kanehira K, Tsunekuni R. Intracontinental and intercontinental dissemination of Asian H5 highly pathogenic avian influenza virus (clade 2.3.4.4) in the winter of 2014-2015. Reviews in Medical Virology, 2015, 25(6): 388-405. DOI:10.1002/rmv.1857 |
| [14] | Ozawa M, Matsuu A, Tokorozaki K, Horie M, Masatani T, Nakagawa H, Okuya K, Kawabata T, Toda S. Genetic diversity of highly pathogenic H5N8 avian influenza viruses at a single overwintering site of migratory birds in Japan, 2014/15. Eurosurveillance, 2015, 20(20): 21132. |
| [15] | Kanehira K, Uchida Y, Takemae N, Hikono H, Tsunekuni R, Saito T. Characterization of an H5N8 influenza A virus isolated from chickens during an outbreak of severe avian influenza in Japan in April 2014. Archives of Virology, 2015, 160(7): 1629-1643. DOI:10.1007/s00705-015-2428-9 |
| [16] | Huang PY, Lee CCD, Yip CH, Cheung CL, Yu GC, Lam TTY, Smith DK, Zhu HC, Guan Y. Genetic characterization of highly pathogenic H5 influenza viruses from poultry in Taiwan, 2015. Infection, Genetics and Evolution, 2016, 38: 96-100. DOI:10.1016/j.meegid.2015.12.006 |
| [17] | Lee MS, Chen LH, Chen YP, Liu YP, Li WC, Lin YL, Lee F. Highly pathogenic avian influenza viruses H5N2, H5N3, and H5N8 in Taiwan in 2015. Veterinary Microbiology, 2016, 187: 50-57. DOI:10.1016/j.vetmic.2016.03.012 |
| [18] | Harder T, Maurer-Stroh S, Pohlmann A, Starick E, Höreth-Böntgen D, Albrecht K, Pannwitz G, Teifke J, Gunalan V, Lee RTC, Sauter-Louis C, Homeier T, Staubach C, Wolf C, Strebelow G, Höper D, Grund C, Conraths FJ, Mettenleiter TC, Beer M. Influenza A (H5N8) virus similar to strain in Korea causing highly pathogenic avian influenza in Germany. Emerging Infectious Diseases, 2015, 21(5): 860-863. DOI:10.3201/eid2105.141897 |
| [19] | Bouwstra R, Heutink R, Bossers A, Harders F, Koch G, Elbers A. Full-genome sequence of influenza A (H5N8) virus in poultry linked to sequences of strains from Asia, the Netherlands, 2014. Emerging Infectious Diseases, 2015, 21(5): 872-874. DOI:10.3201/eid2105.141839 |
| [20] | Verhagen JH, Van Der Jeugd HP, Nolet BA, Slaterus R, Kharitonov SP, De Vries PP, Vuong O, Majoor F, Kuiken T, Fouchier RA. Wild bird surveillance around outbreaks of highly pathogenic avian influenza A (H5N8) virus in the Netherlands, 2014, within the context of global flyways. Eurosurveillance, 2015, 20(12): 21069. |
| [21] | Ip HS, Torchetti MK, Crespo R, Kohrs P, DeBruyn P, Mansfield KG, Baszler T, Badcoe L, Bodenstein B, Shearn-Bochsler V, Killian ML, Pedersen JC, Hines N, Gidlewski T, DeLiberto T, Sleeman JM. Novel Eurasian highly pathogenic avian influenza A H5 viruses in wild birds, Washington, USA, 2014. Emerging Infectious Diseases, 2015, 21(5): 886-890. DOI:10.3201/eid2105.142020 |
| [22] | Li MX, Liu HZ, Bi YH, Sun JQ, Wong G, Liu D, Li LX, Liu JX, Chen QJ, Wang HZ, He YB, Shi WF, Gao GF, Chen JJ. Highly pathogenic avian influenza A (H5N8) virus in wild migratory birds, Qinghai lake, China. Emerging Infectious Diseases, 2017, 23(4): 637-641. DOI:10.3201/eid2304.161866 |
| [23] | Lee DH, Sharshov K, Swayne DE, Kurskaya O, Sobolev I, Kabilov M, Alekseev A, Irza V, Shestopalov A. Novel reassortant clade 2.3.4.4 avian influenza A (H5N8) virus in wild aquatic birds, Russia, 2016. Emerging Infectious Diseases, 2017, 23(2): 359-360. DOI:10.3201/eid2302.161252 |
| [24] | Nagarajan S, Kumar M, Murugkar HV, Tripathi S, Shukla S, Agarwal S, Dubey G, Nagi RS, Singh VP, Tosh C. Novel reassortant highly pathogenic avian influenza (H5N8) virus in zoos, India. Emerging Infectious Diseases, 2017, 23(4): 717-719. DOI:10.3201/eid2304.161886 |
| [25] | Ghafouri SA, GhalyanchiLangeroudi A, Maghsoudloo H, KH Farahani R, Abdollahi H, Tehrani F, Fallah MH. Clade 2.3.4.4 avian influenza A (H5N8) outbreak in commercial poultry, Iran, 2016:the first report and update data. Tropical Animal Health and Production, 2017, 49(5): 1089-1093. DOI:10.1007/s11250-017-1302-z |
| [26] | Wang JJ, Sun YP, Xu Q, Tan YY, Pu J, Yang HC, Brown EG, Liu JH. Mouse-adapted H9N2 influenza A virus PB2 protein M147L and E627K mutations are critical for high virulence. PLoS ONE, 2012, 7(7): e40752. DOI:10.1371/journal.pone.0040752 |
| [27] | Al-Ghadeer H, Chu DKW, Rihan EMA, Abd-Allah EA, Gu HG, Chin AWH, Qasim IA, Aldoweriej A, Alharbi SS, Al-Aqil MA, Al-Sahaf A, Abdel Rahman SS, Aljassem AH, Abdul-Al A, Aljasir MR, Alhammad YMO, Kasem S, Peiris M, Zaki AZSA, Poon LLM. Circulation of influenza A (H5N8) virus, Saudi Arabia. Emerging Infectious Diseases, 2018, 24(10): 1961-1964. DOI:10.3201/eid2410.180846 |
| [28] | Meier S, Hüssy D, Hofmann M, Renzullo S, Vogler B, Sigrist B, Hoop R, Albini S. Outbreak of highly pathogenic avian influenza H5N8 in November 2016 in wild birds in Switzerland. Schweiz Arch Tierheilkd, 2017, 159(12): 663-667. DOI:10.17236/sat00138 |
| [29] | Moisson MC, Bronner A, Van-De-Wiele A, Humeau A, Calavas D, Schmitz A. Situation de l'influenza aviaire en France au 03/04/2017(20h00). [Internet]. Available at: http://www.plateforme-esa.fr/article/situation-de-l-influenza-aviaire-en-france-au-03042017-20h00. Accessed year 2017. |
| [30] | Kandeil A, Kayed A, Moatasim Y, Webby RJ, McKenzie PP, Kayali G, Ali MA. Genetic characterization of highly pathogenic avian influenza A H5N8 viruses isolated from wild birds in Egypt. The Journal of General Virology, 2017, 98(7): 1573-1586. DOI:10.1099/jgv.0.000847 |
| [31] | Nantima N, Ademun ARO, Sentumbwe J, Ilukor J, Kirumira MM, Muwanga E, Nakanjako MF, Ndumu D, Kiconco D, Arinaitwe E, Monne I, Pavade G, Kamata A, Von Dobschuetz S. Managing the challenges of a highly pathogenic avian influenza H5N8 outbreak in Uganda: a case study. Revue Scientifique et Technique: International Office of Epizootics, 2019, 38(1): 225-237. |
| [32] | Twabela AT, Tshilenge GM, Sakoda Y, Okamatsu M, Bushu E, Kone P, Wiersma L, Zamperin G, Drago A, Zecchin B, Monne I. Highly pathogenic avian influenza A (H5N8) virus, democratic republic of the Congo, 2017. Emerging Infectious Diseases, 2018, 24(7): 1371-1374. DOI:10.3201/eid2407.172123 |
| [33] | Abolnik C, Pieterse R, Peyrot BM, Choma P, Phiri TP, Ebersohn K, Heerden CJV, Vorster AA, Zel GVD, Geertsma PJ, Laleye AT, Govindasamy K, Rauff DL. The incursion and spread of highly pathogenic avian influenza H5N8 clade 2.3.4.4 within South Africa. Avian Diseases, 2091, 63(sp1): 149-156. |
| [34] | Molini U, Aikukutu G, Roux JP, Kemper J, Ntahonshikira C, Marruchella G, Khaiseb S, Cattoli G, Dundon WG. Avian influenza H5N8 outbreak in African penguins (Spheniscus demersus), Namibia, 2019. Journal of Wildlife Diseases, 2020, 56(1): 214. DOI:10.7589/2019-03-067 |
| [35] | Śmietanka K, Świętoń E, Kozak E, Wyrostek K, Tarasiuk K, Tomczyk G, Konopka B, Welz M, Domańska-Blicharz K, Niemczuk K. Highly pathogenic avian influenza H5N8 in Poland in 2019-2020. Journal of Veterinary Research, 2020, 64(4): 469-476. DOI:10.2478/jvetres-2020-0078 |
| [36] | Jeong S, Lee DH, Kwon JH, Kim YJ, Lee SH, Cho AY, Kim TH, Park JE, Lee SI, Song CS. Highly pathogenic avian influenza clade 2.3.4.4b subtype H5N8 virus isolated from mandarin duck in south Korea, 2020. Viruses, 2020, 12(12): 1389. DOI:10.3390/v12121389 |
| [37] | Isoda N, Twabela AT, Bazarragchaa E, Ogasawara K, Hayashi H, Wang ZJ, Kobayashi D, Watanabe Y, Saito K, Kida H, Sakoda Y. Re-invasion of H5N8 high pathogenicity avian influenza virus clade 2.3.4.4b in Hokkaido, Japan, 2020. Viruses, 2020, 12(12): 1439. DOI:10.3390/v12121439 |
| [38] | Li X, Lv X, Li Y, Peng P, Zhou RF, Qin SY, Ma ED, Liu WQ, Fu T, Ma PR, An Q, Li YR, Hua YP, Wang YL, Lei CL, Chu D, Sun HT, Li YB, Gao YW, Chai HL. Highly pathogenic avian influenza A (H5N8) virus in swans, China, 2020. Emerging Infectious Diseases, 2021, 27(6): 1732-1734. DOI:10.3201/eid2706.204727 |
| [39] | 中华人民共和国农业农村部. 山西省平陆县发生野生天鹅H5N8亚型高致病性禽流感疫情. http://www.moa.gov.cn/gk/yjgl_1/yqfb/202011/t20201126_6357113.htm. Accessed year 2020. |
| [40] | 中华人民共和国农业农村部. 山东省东营市发生野生天鹅H5N8亚型高致病性禽流感疫情. http://www.moa.gov.cn/gk/yjgl_1/yqfb/202101/t20210119_6360145.htm. Accessed year 2021. |
| [41] | 中华人民共和国农业农村部. 北京市发生野生天鹅H5N8亚型高致病性禽流感疫情. http://www.moa.gov.cn/gk/yjgl_1/yqfb/202102/t20210201_6360898.htm. Accessed year 2021. |
| [42] | 中华人民共和国农业农村部. 江苏省连云港市发生野禽H5N8亚型高致病性禽流感疫情. http://www.moa.gov.cn/gk/yjgl_1/yqfb/202102/t20210205_6361298.htm. Accessed year 2021. |
| [43] | Napp S, Majó N, Sánchez-Gónzalez R, Vergara-Alert J. Emergence and spread of highly pathogenic avian influenza A (H5N8) in Europe in 2016-2017. Transboundary and Emerging Diseases, 2018, 65(5): 1217-1226. DOI:10.1111/tbed.12861 |
| [44] | Yuk SS, Lee DH, Park JK, Tseren-Ochir EO, Kwon JH, Noh JY, Song CS. Experimental infection of dogs with highly pathogenic avian influenza virus (H5N8). Journal of Veterinary Science, 2017, 18(S1): 381-384. DOI:10.4142/jvs.2017.18.S1.381 |
| [45] | Imai M, Watanabe T, Hatta M, Das SC, Ozawa M, Shinya K, Zhong GX, Hanson A, Katsura H, Watanabe S, Li CJ, Kawakami E, Yamada S, Kiso M, Suzuki Y, Maher EA, Neumann G, Kawaoka Y. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature, 2012, 486(7403): 420-428. DOI:10.1038/nature10831 |
| [46] | Shin DL, Siebert U, Lakemeyer J, Grilo M, Pawliczka I, Wu NH, Valentin-Weigand P, Haas L, Herrler G. Highly pathogenic avian influenza A (H5N8) virus in gray seals, Baltic sea. Emerging Infectious Diseases, 2019, 25(12): 2295-2298. DOI:10.3201/eid2512.181472 |
| [47] | Sun J, Zhao L, Li X, Meng WY, Chu D, Yang XY, Peng P, Zhi M, Qin SY, Fu T, Li JH, Lu SX, Wang WD, He X, Yu MQ, Lv X, Ma WG, Liao MY, Liu ZS, Zhang GG, Wang YL, Li YB, Chai HL, Lu J, Hua YP. Novel H5N6 avian influenza virus reassortants with European H5N8 isolated in migratory birds, China. Transboundary and Emerging Diseases, 2020, 67(2): 648-660. DOI:10.1111/tbed.13380 |
| [48] | Chen P, Xie JF, Lin Q, Zhao L, Zhang YH, Chen HB, Weng YW, Huang Z, Zheng KC. A study of the relationship between human infection with avian influenza a (H5N6) and environmental avian influenza viruses in Fujian, China. BMC Infectious Diseases, 2019, 19(1): 762. DOI:10.1186/s12879-019-4145-6 |
 2022, Vol. 62
2022, Vol. 62