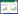中国科学院微生物研究所,中国微生物学会,中国菌物学会
文章信息
- 王俊平, 郑玉玲, 骈亚亚, 郭洁, 郝淮杰, 姜永强. 2015
- Junping Wang, Yuling Zheng, Yaya Pian, Jie Guo, Huaijie Hao, Yongqiang Jiang. 2015
- 猪链球菌2型Ⅳ型分泌系统组分VirD4与毒力相关性分析
- Correlation between Type Ⅳ secretion system component VirD4 and virulence for Streptococcus suis 2
- 微生物学报, 2015,55(5): 643-649
- Acta Microbiologica Sinica, 2015,55(5): 643-649
-
文章历史
- 收稿日期:2014-08-03
- 修回日期:2014-10-24
2. 中国科学院微生物研究所, 病原微生物与免疫学重点实验室, 北京 100101
2. Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
猪链球菌2型(Streptococcus suis serotype 2,S. suis 2,SS2)是一种重要的人兽共患病病原菌,能引起人和猪的脑膜炎、心内膜炎、关节炎、肺炎、菌血症以及突发性死亡[1]。1998年和2005年在我国江苏和四川两地局部地区暴发了较大规模的猪及人感染猪链球菌的病例,不但造成猪的大量死亡,而且累计报告人感染猪链球菌病例204例,其中死亡38例[2],不仅给人类和养猪业带来巨大威胁,而且也是一起严重社会公共卫生安全问题。特别是这两次猪链球菌暴发不仅引起菌血症和脑膜炎,而且重症患者还多表现为链球菌中毒性休克综合征(STSS)。毒力因子在S.suis 2感染中起关键作用,目前文献报道的毒力因子包括:溶菌酶释放蛋白(muramidase-released protein,MRP)和胞外因子(extra-cellular protein factor,EF)[3, 4]、溶血素(suilysin,SLY)[5]、荚膜多糖(capsule polysaccharide,CPS)[6]、H因子结合蛋白(Fhb)[7]、腺苷合成酶(Ssads)[8]、Ⅳ型分泌系统(VirD4-89K and VirB4-89K)[9]等,然而由于毒力因子的复杂性和多样性,猪链球菌2型的致病机制,尤其早期抗宿主天然免疫方面的作用机制仍需不断探究。我国科研工作者对两株高致病性的猪链球菌2型98HAH12和05ZYH33的基因组测序比对时发现一个89 kb的毒力岛PAI,命名为89 K,而此PAI仅在中国高致病性SS2流行株中存在[9]。89 K毒力岛功能注释结果显示可能与毒力相关的基因有:3个控制物质运输的ABC transporter,2个双组分调控系统(TCS),3个Ⅳ型分泌系统(T4SS)的组件。T4SS是接触依赖性分泌系统,被该系统转运的都是一些大分子物质,如核蛋白颗粒、多个亚单位毒素等,涉及多种病理生理作用。
本研究利用实验室成熟的基因敲除技术获得了89 K毒力岛上T4SS中VirD4(gene 0973)基因的敲除突变株ΔVirD4,体外全血存活模型证明VirD4有较强的抗吞噬作用,体内动物模型证明VirD4是猪链球菌2型的一个新毒力因子,为进一步研究T4SS在猪链球菌2型抗宿主天然免疫细胞杀伤中的作用提供重要实验依据。
1 材料和方法 1.1 材料 1.1.1 菌株、质粒与引物:本研究所用菌株、质粒及引物见表1。| Strain,plasmid,or primer | Descriptiona or sequenceb | Source or PCR product |
| aAmpR,ampicillin resistant; CmR,chloromycetin resistant; SpcR,spectinomycin resistant; bUnderlined sequences are the restriction digestion sites. | ||
| E. coli DH5α | Host for cloning vector | In this lab |
| 05ZYH33 | Virulent Chinese S. suis 2 isolate | In this lab |
| ΔVirD4 | Gene VirD4 knockout mutant strain; CmR | This study |
| pMD18T | TA cloning vector,lacZ,AmpR | TaKaRa |
| pSET1 | S. suis-E. coli shuttle vector,CmR | Takamatsu et al.(2001) |
| pSET4s | Gene replacement vector with MCS of pUC19,SpcR | Takamatsu et al.(2001) |
| pSET4s∷VirD4 | The gene VirD4 knockout plasmid,SpcR CmR | This study |
| VirD4 KOP1 | GCAGGATCCCTAGGCAAGCCTTAGCTC | VirD4 gene and its upstream flanking region |
| VirD4 KOP2 | CCTCGGAACCCATCGAATTACAAATCGTTCCATAGGTG | |
| CM-F | TAATTCGATGGGTTCCGAGG | Chloramphenicol resistant gene |
| CM-R | CACCGAACTAGAGCTTGATG | |
| VirD4 KOP5 | CATCAAGCTCTAGTTCGGTGGAAATGGCTTGCGGATAA | VirD4 gene and its downstream flanking region |
| VirD4 KOP6 | GCGGAATTCTGGCGGTCGATTCTAAAT | |
| SPC-F | GTGTTCGTGAATACATGTTATA | Spectinomycin resistant gene |
| SPC-R | GTTTTCTAAAATCTGATTACCA | |
| mrp-F | GGAGCTGAAGTTGATGCCT | A fragment of mrp gene |
| mrp-R | GGTCGTTCTCCACAATTTCACG | |
利用Interproscan 4.0软件对猪链球菌2型强毒株05ZYH33 89 K毒力岛上的Ⅳ型分泌系统组分VirD4氨基酸序列结构域进行预测分析。
1.3 细菌培养将野生株05ZYH33的菌液通过分区划线法接种于哥伦比亚血琼脂平板,37℃、5% CO2培养箱培养18-24 h。然后挑取单克隆菌落接种于THB液体培养基,培养18 h至生长稳定期,再按1%的比例转接,培养8 h至稳定期前期并用于后续实验,突变株ΔVirD4的培养方法与野生株相同,但培养基含5 mg/L氯霉素。大肠杆菌DH5α培养于LB液体培养基,37℃震荡培养(大观霉素在LB培养基中的浓度为100 mg/L)。
1.4 基因敲除载体的构建用基因组提取试剂盒提取05ZYH33基因组,并以此为模板,以VirD4 KOP 1/2为引物扩增上游同源臂,以VirD4 KOP 5/6为引物扩增下游同源臂,以pSET1载体为模板,CM-F/R为引物扩增氯霉素抗性盒。以切胶回收的上述3个片段为模板,VirD4 KOP 1/6为引物,通过重叠PCR方法扩增上下游同源臂中间嵌合氯霉素抗性盒的融合片段。通过内切酶BamH I、EcoR I同时酶切重叠片段及自杀载体pSET4S,接着用T4 DNA连接酶16℃连接过夜,鉴定可通过菌落PCR方法。基因敲除载体pSET4s∷VirD4的构建及突变体的筛选如图1所示。
|
| 图 1. pSET4S质粒图谱与基因敲除载体的构建示意图 Figure 1. Plasmid profile of pSET4s and construction diagram of gene knock-out vector. |
制备猪链球菌05ZYH33电转化感受态细胞。将基因敲除载体pSET4s∷VirD4约l μg加入到100 μL感受态细胞中,轻微混匀后加到2 mm的电转杯中,冰浴10 min,以2.5 kV/cm,200 Ω,25 μF电转化参数进行电击,然后立即加入l mL电转复苏液,在30℃,140 r/min空气摇床中复苏3-4 h,短暂离心后涂布于THBCmR平板,在30℃、5% CO2培养箱内培养48 h,挑选正确的克隆,先后经30℃双交换和40℃质粒丢失,最后通过点板的方法获得基因敲除突变株。成功敲除的突变株CmR阳性,SpcR阴性,SS2鉴定引物(MRP)阳性,使用VirD4 KOP 3/4扩增阴性,使用VirD4 KOP 1/6扩增出上下游同源臂和Cm抗性盒的融合基因。如果PCR扩增结果符合上述预期表明VirD4基因敲除成功。
1.6 ΔVirD4生物活性分析将野生株05ZYH33和突变株ΔVirD4分别分区划线接种于血琼脂平板,在37℃、5% CO2培养箱中培养18 h,观察菌落形态及溶血环大小。将野生株05ZYH33和突变株ΔVirD4稳定期菌液按1%比例转接,在37℃、5% CO2培养箱内培养,每隔1 h取菌液测量OD600,培养至14 h,绘制生长曲线。
1.7 全血杀伤实验将稳定期的野生株05ZYH33和突变株ΔVirD4菌液稀释至约104 CFU /mL,取50 μL加入到400 μL人血中,37℃、5% CO2,20 r/min孵育1 h,并将原始菌量稀释合适浓度涂板计数。取出孵育后全血,加入50 μL 1% saponin冰上裂解15 min并稀释涂板计数,按公式(1)计算杀菌率。
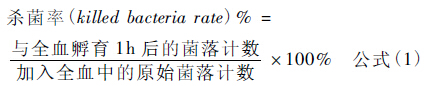
将野生株05ZYH33和突变株ΔVirD4稳定期前期菌液等比例混合后,稀释10倍,腹腔注射雌性、体重(26±2) g的CD1小鼠6只,每只1 mL,各自的原始菌量稀释至10-6涂板计数。注射6 h后眼球取血,并用无菌PBS稀释后涂布于THB和THB CmR平板,在37℃、5% CO2培养箱内培养18 h,菌落计数。THB平板生长菌落为野生株05ZYH33和突变株ΔVirD4,THB CmR抗性平板生长菌落则为突变株ΔVirD4。按公式(2)计算竞争感染指数(CI)。

另取一批体重(26±2) g的CD1雌性小鼠,随机分成3组,每组10只,分别腹腔注射生长稳定期前期10倍稀释的野生株05ZYH33、突变株ΔVirD4菌液和无菌PBS,每只注射1.0 mL,并将各自原始菌液用无菌PBS稀释至10-6涂板、培养、计数。注射后及时观察CD1小鼠的发病和存活情况。
2 结果 2.1 VirD4基因生物信息学分析利用Interprosan软件(http://www.ebi.ac.uk/Tools)对VirD4氨基酸序列进行预测分析,如图2所示,发现其具备典型的T4SS结构域特征,但未发现其他同源结构域。

|
| 图 2. VirD4氨基酸序列预测分析 Figure 2. Amino acid sequence prediction analysis of VirD4. |
以05ZYH33基因组DNA为模板,用引物VirD4 KOP 1/2,VirD4 KOP 5/6扩增出VirD4上游同源臂(512 bp)和下游同源臂(515 bp),同时用引物CM-F/R从pSET1质粒中扩增出Cm基因(1056 bp),结果如图3-A所示。采用重叠PCR方法搭建上述3个片段,胶回收产物如图3-B所示。将重叠PCR产物先连接到T载体,转化扩增后经BamH I和EcoR I双酶切回收重叠PCR产物,同时BamH I和EcoR I双酶切pSET4s载体并胶回收,结果如图3-C所示。T4 DNA连接酶连接上述双酶切产物,转化DH5α,菌落PCR鉴定阳性结果并酶切验证,结果如图3D所示,最后对重组质粒测序,结果显示3个片段连接次序及序列完全正确,说明基因敲除载体pSET4s∷VirD4构建成功。
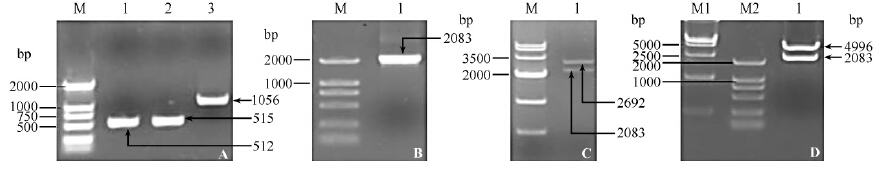
|
| 图 3. 基因敲除载体pSET4s∷VirD4的构建和鉴定 Figure 3. Construction of gene knock-out vector pSET4s∷VirD4. A: M,DL-2000 DNA Marker; lane 1-3: PCR products with VirD4 KOP 1/2,PCR products with KOP 5/6,Cm gene cassette. B: M,DL-2000 DNA Marker; lane 1: Products of overlap extension PCR. C: M,DL-5000 DNA Marker; lane 1: VirD4-pMD18T digested by EcoR I and BamH I. D: M1,DL-5000 DNA Marker; M2: DL-2000 DNA Marker; lane 2: pSET4s∷VirD4 digested by EcoR I and BamH I. |
提取突变株ΔVirD4-89K基因组作模板,分别设计5对引物MRP F/R,CM F/R,SPCF/R,VirD4 KOP 3/4,VirD4 KOP 1/6进行PCR鉴定,结果如图4所示,MRP为猪链球菌特有基因,确定菌株未被污染,SPC证明突变株是双交换而非单交换,CM说明Cm基因替换基因VirD4成功,VirD4 KOP 3/4扩增不出基因VirD4的520 bp目的片段,VirD4 KOP 1/6扩增出2083 bp片段,而基因VirD4本身全长714 bp,同时对ΔVirD4基因组进行基因测序,结果显示基因VirD4完全被Cm基因所替代,证明突变体构建成功。

|
| 图 4. 基因敲除突变株ΔVirD4的PCR验证 Figure 4. PCR identification of knock-out mutant ΔVirD4. M: DL-5000 DNA Marker; lane 1-5: PCR products with MRP F/R,CM F/R,SPC F/R,VirD4 KOP 3/4,VirD4 KOP 1/6 using ΔVirD4 genomic DNA; lane 6: Negative control; lane 7: Positive control. |
将野生株05ZYH33与突变株ΔVirD4涂布于血平板,于37℃、5% CO2培养箱内培养18 h后观察菌落特征,发现两者无论是菌落形态还是溶血环大小无明显区别。突变株ΔVirD4和野生株05ZYH33的生长曲线如图5所示,可见二者生长速度较为一致。
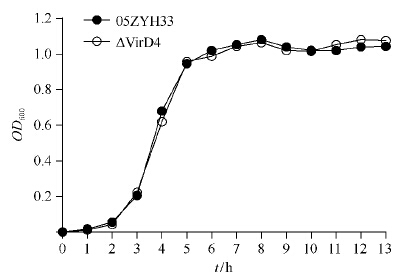
|
| 图 5. 突变株与野生株的生长曲线比较 Figure 5. The growth curve of mutant strain against wild strain. |
将野生株05ZYH33和突变株ΔVirD4分别与人的全血孵育1 h后,稀释计数并计算杀菌率,结果图6所示。与野生株05ZYH33的杀菌率32.97%相比,突变株ΔVirD4的为60.75%(3份人全血的均值),两者差异具有统计学意义(P < 0.01),说明ΔVirD4在人的全血中抵御血液中天然免疫细胞主要是多形核白细胞(Polymorphonuclear Leukocytes,PMN)的吞噬和杀菌能力有所减弱。
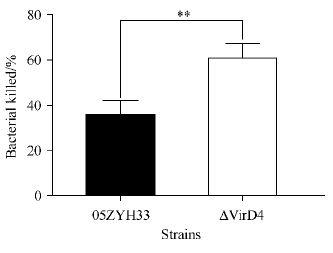
|
| 图 6. 全血对野生株和突变株的杀菌能力比较(**: P < 0.01) Figure 6. The capacity of whole blood killing of wild strain against mutant strain(**: P < 0.01). |
对6只CD1小鼠进行竞争感染实验,小鼠腹腔注射前的野生株05ZYH33和突变株ΔVirD4的OD600值分别为1.062和1.106,菌落计数分别为2.35×109CFU/mL、2.46×109 CFU/mL(两块THB板的均值)。注射后6 h眼球取血涂平板,菌落计数,计算竞争感染指数,结果为0.6976±0.0936,CI值小于1.0,如图7-A所示。CD1小鼠攻毒实验中,小鼠腹腔注射前的野生株05ZYH33和突变株ΔVirD4的菌落计数分别为2.38×109 CFU/mL、2.51×109 CFU/mL(两块THB板的均值)。3 h后05ZYH33组和ΔVirD4组部分小鼠出现精神萎靡、体态不稳、不进食的症状,7 h后发病小鼠开始出现死亡,12 h后05ZYH33组CD 1小鼠全部死亡,观察截止到60 h,此时ΔVirD4组CD1小鼠50%死亡,而对照PBS组全部存活,结果如图7-B所示。可以看出突变株相对于野生株来说,在小鼠体内增殖更易被抑制和清除,提示VirD4可能与其毒力相关。
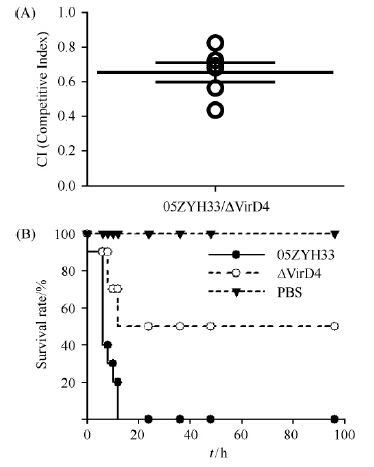
|
| 图 7. CD1小鼠突变株与野生株竞争感染指数(A)和存活曲线(B) Figure 7. The competitive index(A) and survival curve of CD1(B) of wild type strain against mutant strain with CD1 mice. |
通过生物信息学比对,05ZYH33株T4SS位于89 K PAI的5'端,其中与致癌农杆菌Ⅳ分泌系统VirB/VirD复合体毒力基因有4个同源基因[10]。细菌的T4SS可以输送一些生物活性效应物,通过细菌和真核细胞的细胞膜,作用于靶细胞,从而发挥其致病性[11]。有研究发现,在一些革兰氏阴性菌,T4SS参与先天免疫的调节和机体细胞因子的释放[12]。例如,在小鼠体内,布鲁氏菌T4SS可通过两种方式参与先天免疫,一是直接引起细菌效应分子的释放,从而被天然免疫系统感知;二是可使含有布鲁氏菌的吞噬体与巨噬细胞的内质网相互作用并发生融合,避免与溶酶体的融合,从而使布鲁氏菌逃避巨噬细胞的天然杀伤[13]。
研究发现,在BALB/C小鼠的动物感染实验中,敲除了Ⅳ型分泌系统两个关键基因(VirD4或VirB4)的猪链球菌2型突变株,不但小鼠的感染致死率明显降低,而且其引发小鼠免疫应答的能力也大为减弱[10]。在本研究中,我们采用CD1小鼠和仔猪作为毒力筛选的动物模型。虽然有研究认为同一菌株在猪和小鼠体内可表现出不同的毒力反应,如S735在猪中表现为温和毒力,在小鼠体内却表现为强毒力[14]。但Quessy等的研究认为CD1小鼠和猪对致病性猪链球菌2型都表现出较高的敏感性,而且不同的分离株在猪和小鼠模型中表现出的毒力强弱状况也较为一致[15]。
我们对猪链球菌2型VirD4基因采用同源重组的方法进行了敲除,并通过人全血杀伤模型、CD1小鼠竞争感染实验和攻毒试验、仔猪竞争感染实验比较了突变株ΔVirD4和野生株的毒力变化。de Greeff等研究者首次通过竞争性感染仔猪实验比较猪链球菌纤连蛋白结合蛋白突变株与野生株的毒力变化,之后这种实验方法在此类研究中被广泛采用[16]。采用这种竞争混合感染的方法不但可以减少实验动物的使用量,而且还能降低动物间个体差异对数据的影响。在CD1小鼠竞争感染实验中CI值均小于1.0,说明突变株ΔVirD4在CD1小鼠体内较野生株05ZYH33而言增殖受到了抑制。CD1小鼠的攻毒试验,18 h后野生株全部死亡,而ΔVirD4观察100 h,死亡50%,也说明VirD4可能为05ZYH33株的一个新的重要毒力因子。同时全血杀伤结果也表明,突变株ΔVirD4在人全血中抵御血液中天然免疫细胞PMN的吞噬和杀菌能力较野生株有明显的减弱,更容易被宿主所清除。从以上结果表明猪链球菌2型Ⅳ型分泌系统组分VirD4与其毒力相关,为05ZYH33株的一个新的重要毒力因子,并在早期抵抗天然免疫细胞杀伤中发挥一定作用,但其如何逃避宿主天然免疫防御引发严重感染的具体作用机制还需进一步研究。
| [1] | Feng Y, Zhang H, Ma Y, Gao GF. Uncovering newly emerging variants of Streptococcus suis, an important zoonotic agent. Trends in Microbiology, 2010, 18(3): 124-131. |
| [2] | Tang J, Wang C, Feng Y, Yang W, Song H, Chen Z, Yu H, Pan X, Zhou X, Wang H, Wu B, Wang H, Zhao H, Lin Y, Yue J, Wu Z, He X, Gao F, Khan AH, Wang J, Zhao GP, Wang Y, Wang X, Chen Z, Gao GF. Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2. PLoS Medicine, 2006, 3: e151. |
| [3] | Vecht U, Wisselink HJ, van Dijk JE, Smith HE. Virulence of Streptococcus suis type 2 strains in newborn germfree pigs depends on phenotype. Infection and Immunity, 1992, 60(2): 550-556. |
| [4] | Martinez G, Pestana de Castro AF, Ribeiro Pagnani KJ, Nakazato G, Dias da Silveira W, Gottschalk M. Clonal distribution of an atypical MRP+, EF*, and suilysin+ phenotype of virulent Streptococcus suis serotype 2 strains in Brazil. Canadian Journal of Veterinary Research, 2003, 67(1): 52-55. |
| [5] | Lecours MP, Gottschalk M, Houde M, Lemire P, Fittipaldi N, Sequra M. Critical role for Streptococcus suis cell wall modifications and suilysin in resistance to complement-dependent killing by dendritic cells. The Journal of Infectious Disease, 2011, 204(6): 919-929. |
| [6] | Chabot-Roy G, Willson P, Segura M, Lacouture S, Gottschalk M. Phagocytosis and killing of Streptococcus suis by porcine neutrophils. Microbial Pathogenesis, 2006, 41(1): 21-32. |
| [7] | Pian Y, Gan S, Wang S, Guo J, Wang P, Zheng Y, Cai X, Jiang Y, Yuan Y. Fhb, a novel factor H-binding surface protein, contributes to the antiphagocytic ability and virulence of Streptococcus suis. Infection and Immunity, 2012, 80 (7): 2402-2413. |
| [8] | Liu P, Pian Y, Li X, Xie W, Zhang C, Zheng Y, Jiang Y, Yuan Y. Streptococcus suis Adenosine synthase functions as an effector in evasion of PMN-mediated innate immunity. The Journal of Infectious Disease, 2014, 210 (1): 35-45. |
| [9] | Chen C, Tang J, Dong W, Wang C, Feng Y, Wang J, Zheng F, Pan X, Liu D, Li M, Song Y, Zhu X, Sun H, Feng T, Guo Z, Ju A, Ge J, Dong Y, Sun W, Jiang Y, Wang J, Yan J, Yang H, Wang X, Gao GF, Yang R, Wang J, Yu J. A glimpse of streptococcal toxic shock syndrome from comparative genomics of S. suis 2 Chinese isolates. PLoS One, 2007, 2(3): e315. |
| [10] | Zhao Y, Liu G, Li S, Wang M, Wang J, Tang J, Li M, Hu F. Role of a type IV-like secretion system of Streptococcus suis 2 in the development of streptococcal toxic shock syndrome. The Journal of Infectious Diseases, 2011, 204(2): 274-81. |
| [11] | Christie PJ, Atmakuri K, Krishnamoorthy V, Jakubowski S, Cascales E. Biogenesis, architecture, and function of bacterial type IV secretion systems. Annual Review of Microbiology, 2005, 59: 451-85. |
| [12] | Takamatsu R, Teruya H, Takeshima E, Ishikawa C, Matsumoto K, Mukaida N, Li JD, Heuner K, Higa F, Fujita J, Mori N. Molecular characterization of Legionella pneumophila-induced interleukin-8 expression in T cells. BMC Microbiology, 2010, 10: 1. |
| [13] | Celli J, de Chastellier C, Franchini DM , Pizarro-Cerda J, Moreno E, Gorvel JP. Brucella evades macrophage killing via VirB-dependent sustained interactions with the endoplasmic reticulum. The Journal of Experimental Medicine, 2003, 198(4): 545-56. |
| [14] | Christie PJ. Agrobacterium tumefaciens T-complex transport apparatus: a paradigm for a newfamily of multifunctional transporters in eubacteria. Journal of Bacteriology, 1997, 179(10): 3085-94 |
| [15] | Quessy S, Dubreuil JD, Caya M, Higgins R.Discrimination of virulent and avirulent Streptococcus suis capsular type 2 isolates from different geographical origins. Infection and Immunity, 1995, 63(5): 1975-1979. |
| [16] | de Greeff A, Buys H, Verhaar R, Dijkstra J, van Alphen L, Smith HE. Contribution of fibronectin-binding protein to pathogenesis of Streptococcus suis serotype 2. Infection and Immunity, 2002, 70(3): 1319-25. |
 2015, Vol. 55
2015, Vol. 55